题目内容
【题目】有以下反应方程式:
A.CuO+H2![]() Cu+H2O B.2KClO3
Cu+H2O B.2KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑
C.Cl2+2NaOH==NaCl + NaClO+ H2O D.2FeBr2 + 3Cl2=2FeCl3+ 2Br2
E.MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O G.KClO3+6HCl(浓)==KC1+ 3H2O + 3Cl2↑
MnCl2+Cl2↑+2H2O G.KClO3+6HCl(浓)==KC1+ 3H2O + 3Cl2↑
H.HgS +O2=Hg + SO2
I.按要求将上述化学方程式序号填入相应空格内:
(1)一种单质使一种化合物中的一种元素被还原____________________
(2)同一种物质中,同种元素间发生氧化还原反应________________
(3)所有元素均参加氧化还原反应的是____________________________
(4)发生在不同物质间,只有部分元素被氧化或只有部分元素被还原的反应_______________
II.已知力程式G: KClO3+ 6HCI(浓)=KCl + 3H2O+ 3Cl2↑
(1)请用双线桥法标出电子转移的方向和数目_______________________
(2)标准状况下当有33.6L的氯气放出时,转移电子的数目是_________________________
(3)上述反应中氧化产物和还原产物的质量比为____________________________
【答案】 A C DH EG 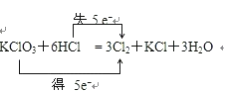 2.5NA(或者1.505×1024) 5:1
2.5NA(或者1.505×1024) 5:1
【解析】A、CuO+H2![]() Cu+H2O,H元素的化合价升高,Cu元素的化合价降低; B、2KClO3
Cu+H2O,H元素的化合价升高,Cu元素的化合价降低; B、2KClO3![]() 2KCl + 3O2↑,Cl元素的化合价降低,O元素的化合价升高;C、Cl2+2NaOH==NaCl + NaClO+ H2O只有Cl元素的化合价变化;D、2FeBr2 + 3Cl2=2FeCl3+ 2Br2,Cl元素的化合价降低,Fe、Br元素的化合价升高;E、MnO2+4HCl(浓)
2KCl + 3O2↑,Cl元素的化合价降低,O元素的化合价升高;C、Cl2+2NaOH==NaCl + NaClO+ H2O只有Cl元素的化合价变化;D、2FeBr2 + 3Cl2=2FeCl3+ 2Br2,Cl元素的化合价降低,Fe、Br元素的化合价升高;E、MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O ,Mn元素的化合价降低,Cl元素的化合价升高;G、KClO3 +6HCl(浓)==KC1+ 3H2O + 3Cl2↑,只有Cl元素的化合价变化;H、HgS +O2=Hg + SO2,S元素的化合价升高,Hg、O元素的化合价降低。
MnCl2+Cl2↑+2H2O ,Mn元素的化合价降低,Cl元素的化合价升高;G、KClO3 +6HCl(浓)==KC1+ 3H2O + 3Cl2↑,只有Cl元素的化合价变化;H、HgS +O2=Hg + SO2,S元素的化合价升高,Hg、O元素的化合价降低。
(1)一种单质使一种化合物中的一种元素被还原的是A;(2)同一种物质中,同种元素间发生氧化还原反应的是C;(3)所有元素均参加氧化还原反应的是DH;(4)发生在不同物质间,只有部分元素被氧化或只有部分元素被还原的反应EG;II.反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 ;(2)由方程式可知:每生成3molCl2,转移的电子数为5mol,标准状况下当有33.6L的氯气放出时,即生成33.6L/22.4L·mol-1=1.5molCl2转移电子的数目是
;(2)由方程式可知:每生成3molCl2,转移的电子数为5mol,标准状况下当有33.6L的氯气放出时,即生成33.6L/22.4L·mol-1=1.5molCl2转移电子的数目是![]() ;(3)上述反应中,由-1价升为0价的氯占5/6,即氧化产物点5/6,由+5价降为0价的氯占1/6,氧化产物和还原产物的质量比为
;(3)上述反应中,由-1价升为0价的氯占5/6,即氧化产物点5/6,由+5价降为0价的氯占1/6,氧化产物和还原产物的质量比为![]() 。
。

 阶梯计算系列答案
阶梯计算系列答案【题目】下列实验操作对应的现象及结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 分別向饱和NaHCO3溶液和饱和NaHSO3溶液中滴加几滴石蕊试剂 | 前者溶液不变色,后者溶液变红 | 非金属性:S>C |
B | 甲烷与氯气的混合气在光照下反应,用湿润 的蓝色石蕊试纸检验反应后生成的气体 | 湿润的蓝色石蕊试纸变红 | 甲烷的氯代物呈酸性 |
C | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是HCl |
D | 向溴水中通入SO2 | 溴水橙黄色褪去 | SO2具有漂白性 |
A. A B. B C. C D. D