题目内容
已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH
、Ba2+、Na+、H+、SO
、NO
、OH-、
CO
.将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成
②D和B反应生成的气体能被A吸收
③A和D反应生成的气体能被B吸收
试回答下列问题:
(1)写出几种物质的化学式:A
(2)写出实验②中有关反应的离子方程式
(3)写出②中反应生成气体的检验方法
(4)少量的A与过量D反应时的离子方程式
+ 4 |
2- 4 |
- 3 |
CO
2- 3 |
①在A或D中滴入C,均有沉淀生成
②D和B反应生成的气体能被A吸收
③A和D反应生成的气体能被B吸收
试回答下列问题:
(1)写出几种物质的化学式:A
H2SO4
H2SO4
BNaOH
NaOH
CBa(NO3)2
Ba(NO3)2
D(NH4)2CO3
(NH4)2CO3
(2)写出实验②中有关反应的离子方程式
NH
+OH-=NH3↑+H2ONH3+H+=NH
+ 4 |
+ 4 |
NH
+OH-=NH3↑+H2ONH3+H+=NH
+ 4 |
+ 4 |
(3)写出②中反应生成气体的检验方法
遇浓盐酸产生白烟或湿润的红色的石蕊试纸变蓝
遇浓盐酸产生白烟或湿润的红色的石蕊试纸变蓝
(4)少量的A与过量D反应时的离子方程式
H++CO32-=HCO3-
H++CO32-=HCO3-
.分析:解答题目的关键是找到突破口.D和A、B都能生成气体,而题给离子中只有H+与CO32-、OH-与NH4+能反应生成气体,故D只能为(NH4)2CO3;在A或D中滴入C,均有沉淀生成,说明A中含有SO42-,C中应含有Ba2+,而A和D反应生成的气体说明A一定是硫酸,产生的气体是二氧化碳,能被B吸收,说明B是一种碱,所以C是硝酸钡,B是氢氧化钠,以此解答该题.
解答:解:(1)以上离子中可能生成的气体有NH3和CO2两种,由D和A、B反应生成,则D中含有CO32-和NH4+离子,应为(NH4)2CO3,在A或D中滴入C,均有沉淀生成,说明A中含有SO42-,C中应含有Ba2+,而A和D反应生成的气体说明A一定是硫酸,产生的气体是二氧化碳,能被B吸收,说明B是一种碱,所以C是硝酸钡,B是氢氧化钠,
故答案为:H2SO4;NaOH;Ba(NO3)2;(NH4)2CO3;
(2)D和B反应生成的气体为NH3,反应的离子方程式为NH4++OH-=NH3↑+H20,能被H2SO4吸收,反应的离子方程式为NH3+H+=NH4+,
故答案为:NH4++OH-=NH3↑+H20、NH3+H+=NH4+;
(3)②中反应生成气体为NH3,氨气的检验方法为:遇浓盐酸产生白烟或湿润的红色的石蕊试纸变蓝,
故答案为:遇浓盐酸产生白烟或湿润的红色的石蕊试纸变蓝;
(4)少量的H2SO4与过量(NH4)2CO3反应时的离子方程式:H++CO32-=HCO3-,故答案为:H++CO32-=HCO3-.
故答案为:H2SO4;NaOH;Ba(NO3)2;(NH4)2CO3;
(2)D和B反应生成的气体为NH3,反应的离子方程式为NH4++OH-=NH3↑+H20,能被H2SO4吸收,反应的离子方程式为NH3+H+=NH4+,
故答案为:NH4++OH-=NH3↑+H20、NH3+H+=NH4+;
(3)②中反应生成气体为NH3,氨气的检验方法为:遇浓盐酸产生白烟或湿润的红色的石蕊试纸变蓝,
故答案为:遇浓盐酸产生白烟或湿润的红色的石蕊试纸变蓝;
(4)少量的H2SO4与过量(NH4)2CO3反应时的离子方程式:H++CO32-=HCO3-,故答案为:H++CO32-=HCO3-.
点评:本题考查离子的检验和推断,题目难度中等,注意解答题目的关键是找到突破口,而本题的突破口为D和A、B都能生成气体.

练习册系列答案
相关题目
 -CH3+CH3COOH
-CH3+CH3COOH



 ,并且互不重复:NH
,并且互不重复:NH 、Ba2+、Na+、H+、SO
、Ba2+、Na+、H+、SO 、NO
、NO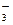 、OH-、CO
、OH-、CO 。将这四种溶液分别标记为A、B、C、D,进行如下实验:
。将这四种溶液分别标记为A、B、C、D,进行如下实验: