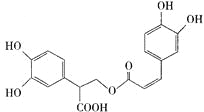
题目内容
【题目】[化学—选修3;物质结构与性质]
明朝《天工开物》中有世界上最早的关于炼锌技术的记载,锌也是人体必需的微量元素。回答下列问题:
(1)基态Zn原子核外的最高能层符号是________,基态Zn2+最外层电子排布式为________。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①组成[Zn(NH3)4]SO4的元素中,除Zn外其余元素的电负性由大到小排序为________。
②向[Zn(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是________。
③已知[Zn(NH3)4]2+的空间构型与![]() 相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为________,NH3易液化的原因是________________________________。
相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为________,NH3易液化的原因是________________________________。
④在[Zn(NH3)4]SO4晶体中存在的作用力有________。
A.离子键 B.极性共价键 C.氢键
D.配位键 E.范德华力 F.金属键
(3)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是________________________________。
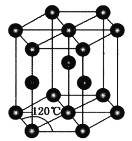
(4)常温下金属锌晶体的晶胞为六方最密堆积(如图所示),若锌原子的半径为rnm,六棱柱的高为![]() ,则金属锌晶体的空间利用率是________(用含π的代数式表示)。
,则金属锌晶体的空间利用率是________(用含π的代数式表示)。
【答案】N 3s23p63d10 O>N>S>H [Zn(NH3)4]2+难电离,溶液中锌离子浓度很小,无法产生沉淀 sp3 氨分子间易形成氢键 ABD 二者同属于离子晶体,O2-的半径比s2-的小,ZnO晶体的晶格能较大 ![]() 或
或![]()
【解析】
(1)Zn是30号元素;基态Zn2+失去最外层两个电子,
(2)①非金属性越强,电负性越强;
②[Zn(NH3)4]2+稳定,在溶液中难电离出Zn2+;
③[Zn(NH3)4]2+空间构型与SO42-相同,为正四面体形,杂化方式相同;
④[Zn(NH3)4]2+与SO42-之间形成离子键,[Zn(NH3)4]2+中Zn2+与NH3之间形成配位键,NH3中、SO42-中原子之间形成极性键;
(3)离子电荷越多、离子半径越小,晶格能越大,离子晶体熔点越高。
(4)空间利用率为晶胞内硬球的总体积占晶胞体积的百分比。
(1)Zn是30号元素,核外电子排布式为1s22s22p62s23p63d104s2;基态Zn2+失去最外层两个电子,
故答案为:N;3s23p63d10
(2)①除Zn外其余元素有N、H、S、O,根据电负性判断方法可知电负性:O>N>S>H,
故答案为:O>N>S>H;
②[Zn(NH3)4]2+稳定,在溶液中难电离出Zn2+,溶液中Zn2+浓度很小,滴加NaOH溶液,无法产生沉淀,
故答案为:[Zn(NH3)4]2+难电离,溶液中锌离子浓度很小,无法产生沉淀;
③[Zn(NH3)4]2+空间构型与SO42-相同,为正四面体形,杂化方式相同,SO42-中心原子价层电子数目=(6+2+0×2)/2=4,杂化方式为sp3杂化,所以Zn2+的杂化类型为sp3杂化;NH3分子间存在氢键,所以易液化
故答案为:sp3;氨分子间易形成氢键;
④[Zn(NH3)4]2+与SO42-之间形成离子键,[Zn(NH3)4]2+中Zn2+与NH3之间形成配位键,NH3中、SO42-中原子之间形成极性键没有非极性键、范德华力、金属键,
故选:ABD;
(3)离子电荷数相同,O2-离子半径比S2-的离子半径小,ZnO晶体的晶格能更大,熔点较高,
故答案为:二者同属于离子晶体,O2-的半径比s2-的小,ZnO晶体的晶格能较大;
(4)底面4个相邻的原子形成的菱形,锐角为60°,Zn原子半径为 rnm,则底面边长为2rnm,底面积=2rnm×2rnm×sin60°=2![]() r2nm2,晶胞的高为
r2nm2,晶胞的高为![]() nm,则晶胞体积=2
nm,则晶胞体积=2![]() r2nm2×
r2nm2×![]() nm=8
nm=8![]() r3nm3,晶胞中Zn原子数目=1+8×1/8=2,Zn原子总体积=
r3nm3,晶胞中Zn原子数目=1+8×1/8=2,Zn原子总体积=![]() 空间利用率=[
空间利用率=[![]() ÷(8
÷(8![]() r3nm3)]×100%=
r3nm3)]×100%=![]() 或
或![]() ;
;
故答案为:![]() 或
或![]() ;
;

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案