题目内容
用NaOH(s)、水、大理石和盐酸制取33 g纯NaHCO3。请参照物质的溶解度表回答下列问题:(1)写出制取过程中反应的化学方程式。
(2)若提供100 g水,则需NaOH的物质的量为多少?
(3)简述实验的操作过程。
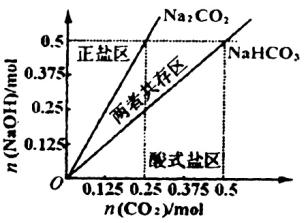
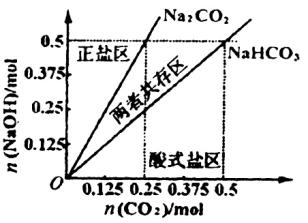
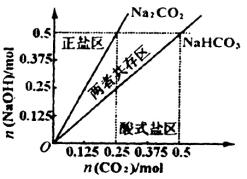
(4)在右图中反映上述实验过程的图象中,标出A点(即当![]() =
=![]() 且n(
且n(![]() )=)0.125 mol时)的位置,并判断此时所得盐的组成及其物质的量。
)=)0.125 mol时)的位置,并判断此时所得盐的组成及其物质的量。
答案:
解析:
提示:
解析:
| (1)
|
提示:
| 大理石主要成分是碳酸钙,其和盐酸反应生成二氧化碳,不断通入NaOH中至过量可得到NaHCO3。其中整个反应过程碳元素是守恒的。
|

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
参照下表几种物质的溶解度,用固体NaOH、水、CaCO3(s)、盐酸为原料制取33 g纯NaHCO3晶体。
25 ℃ | 溶解度 |
NaHCO3 | 9 |
Na2CO3 | 33 |
NaOH | 110 |
(1)若用水100 g,则制取时需NaOH________________g。
(2)若用NaOH(s)17.86 g,则需用水_______________________g。
参照下表几种物质的溶解度,用固体NaOH、水、CaCO3(s)、盐酸为原料制取33 g纯NaHCO3晶体。
| 25 ℃时溶解度/g | |
| NaHCO3 | 9 |
| Na2CO3 | 33 |
| NaOH | 110 |
(1)若用水100 g,则制取时需NaOH g。
(2)若用NaOH(s)17.86 g,则需用水 g。