题目内容
甲醇燃料电池可用于笔记本电脑、汽车等,它一极通入甲醇,电解质是能够传导氢离子的溶液,电池工作时,甲醇被氧化为CO2和H2O,下列叙述不正确的是( )A.电池总反应为:2CH3OH+3O2=2CO2+4H2O
B.负极的反应为:
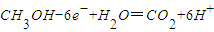
C.正极的反应是:
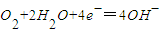
D.电池工作时,H+移向正极
【答案】分析:甲醇燃料电池中,负极上甲醇失电子发生氧化反应,正极上氧气得电子发生还原反应,原电池放电时,电解质溶液中阳离子向正极移动.
解答:解:A.甲醇燃料电池中,甲醇和氧气反应生成二氧化碳和水,所以电池反应式为:2CH3OH+3O2═2CO2+4H2O,故A正确;
B.负极上甲醇失电子和水反应生成二氧化碳和氢离子,所以电极反应式为:2CH3OH+3O2═2CO2+4H2O,故B正确;
C.正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4H++4e-═2H2O,故C错误;
D.该原电池放电时,氢离子由负极向正极移动,故D正确;
故选C.
点评:本题考查了原电池原理,明确元素的化合价变化、氧化还原反应与原电池反应的关系是解答本题的关系,注意电解质溶液中阴阳离子的移动方向,为易错点.
解答:解:A.甲醇燃料电池中,甲醇和氧气反应生成二氧化碳和水,所以电池反应式为:2CH3OH+3O2═2CO2+4H2O,故A正确;
B.负极上甲醇失电子和水反应生成二氧化碳和氢离子,所以电极反应式为:2CH3OH+3O2═2CO2+4H2O,故B正确;
C.正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4H++4e-═2H2O,故C错误;
D.该原电池放电时,氢离子由负极向正极移动,故D正确;
故选C.
点评:本题考查了原电池原理,明确元素的化合价变化、氧化还原反应与原电池反应的关系是解答本题的关系,注意电解质溶液中阴阳离子的移动方向,为易错点.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目