题目内容
回答下列有关氧化还原反应的问题:
(1)在下列反应中:A.2F2+2H2O=4HF+O2↑;
B.2Na+2H2O=2NaOH+H2↑;
C.CaO+H2O=Ca(OH)2;D.2H2O 2H2↑+O2↑.其中水只是氧化剂的是______,水只是还原剂的是______,水既是氧化剂,又是还原剂的是______,水既不是氧化剂,又不是还原剂的是______(填序号).
2H2↑+O2↑.其中水只是氧化剂的是______,水只是还原剂的是______,水既是氧化剂,又是还原剂的是______,水既不是氧化剂,又不是还原剂的是______(填序号).
(2)印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”生成CuCl2和FeCl2,其反应的化学方程式如下:Cu+2FeCl3═CuCl2+2FeCl2
①请用双线桥法在上式中标出电子转移的情况
②试比较Fe3+、Cu2+、Fe2+氧化性的强弱:______>______>______.
解:(1)2Na+2H2O=2NaOH+H2↑中,H元素化合价降低,被还原,则水只是氧化剂;反应2F2+2H2O=4HF+O2↑中,O元素化合价升高,被氧化,水只是还原剂;反应2H2O 2H2↑+O2↑中,H、O元素化合价变化,水既是氧化剂,又是还原剂,反应CaO+H2O=Ca(OH)2中,H、O元素化合价没有发生变化,水既不是氧化剂,又不是还原剂,
2H2↑+O2↑中,H、O元素化合价变化,水既是氧化剂,又是还原剂,反应CaO+H2O=Ca(OH)2中,H、O元素化合价没有发生变化,水既不是氧化剂,又不是还原剂,
故答案为:B;A;D;C;
(2)①在氧化还原反应中氧化剂得到电子,氧化剂和还原剂之间得失电子数目相等,用双线桥法可表示为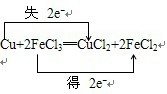 ,故答案为:
,故答案为: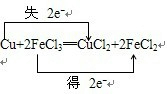 ;
;
②反应Cu+2Fe2+═Cu2++2Fe2+中,氧化剂是Fe3+,氧化产物是Cu2+,氧化剂的氧化性大于氧化产物的氧化性,所以氧化性Fe3+>Cu2+,活泼性金属铁强于金属铜,所以氧化性Cu2+>Fe2+,故答案为:Fe3+;Cu2+;Fe2+.
分析:(1)根据元素化合价是否发生变化,以及变化的趋势判断物质在氧化还原反应中的表现的性质;
(2)在氧化还原反应中氧化剂得到电子,氧化剂和还原剂之间得失电子数目相等,根据氧化剂氧化性大于氧化产物的氧化性判断.
点评:本题是一道物质的氧化性和还原性强弱的比较知识题目,注意规律:氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性.
 2H2↑+O2↑中,H、O元素化合价变化,水既是氧化剂,又是还原剂,反应CaO+H2O=Ca(OH)2中,H、O元素化合价没有发生变化,水既不是氧化剂,又不是还原剂,
2H2↑+O2↑中,H、O元素化合价变化,水既是氧化剂,又是还原剂,反应CaO+H2O=Ca(OH)2中,H、O元素化合价没有发生变化,水既不是氧化剂,又不是还原剂,故答案为:B;A;D;C;
(2)①在氧化还原反应中氧化剂得到电子,氧化剂和还原剂之间得失电子数目相等,用双线桥法可表示为
 ,故答案为:
,故答案为: ;
;②反应Cu+2Fe2+═Cu2++2Fe2+中,氧化剂是Fe3+,氧化产物是Cu2+,氧化剂的氧化性大于氧化产物的氧化性,所以氧化性Fe3+>Cu2+,活泼性金属铁强于金属铜,所以氧化性Cu2+>Fe2+,故答案为:Fe3+;Cu2+;Fe2+.
分析:(1)根据元素化合价是否发生变化,以及变化的趋势判断物质在氧化还原反应中的表现的性质;
(2)在氧化还原反应中氧化剂得到电子,氧化剂和还原剂之间得失电子数目相等,根据氧化剂氧化性大于氧化产物的氧化性判断.
点评:本题是一道物质的氧化性和还原性强弱的比较知识题目,注意规律:氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目



 2H2↑+O2↑.其中水只是氧化剂的是 ,水只是还原剂的是 ,水既是氧化剂,又是还原剂的是 ,水既不是氧化剂,又不是还原剂的是 (填序号).
2H2↑+O2↑.其中水只是氧化剂的是 ,水只是还原剂的是 ,水既是氧化剂,又是还原剂的是 ,水既不是氧化剂,又不是还原剂的是 (填序号).