题目内容
【题目】某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。
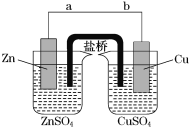
按照实验步骤依次回答下列问题:
(1)导线中电子流向为__________________(用a、b表示)。
(2)写出装置中锌电极上的电极反应式:____________________________________;
(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为________;(不许用“NA”表示)
(4)装置的盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
【答案】(1)由a到b(或a→b)
(2)Zn-2e-=Zn2+
(3)1.204×1022
(4)B
【解析】在该原电池中负极为Zn,电极反应为Zn-2e-=Zn2+,正极为铜,电极反应为Cu2++2e-=Cu,当铜电极增加0.64 g时,转移电子(由a到b)为![]() ×6.02×1023 mol-1×2=1.204×1022。盐桥中K+向正极区(右侧烧杯)移动,Cl-向负极区(左侧烧杯)移动。
×6.02×1023 mol-1×2=1.204×1022。盐桥中K+向正极区(右侧烧杯)移动,Cl-向负极区(左侧烧杯)移动。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目