题目内容
【题目】下面有关化学反应速率和限度的图象和实验结论表达均正确的是![]()
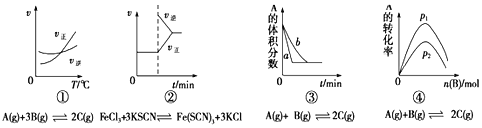
A.图①是其他条件一定时反应速率随温度变化的图象,图象表明该反应的![]()
B.图②是在平衡体系的溶液中加入少量KCl晶体后化学反应速率随时间的变化
C.图③可能是压强对化学平衡的影响
D.图④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强![]()
【答案】C
【解析】
![]() 由图可知,升高温度正反应速率大于逆反应速率,平衡正向移动,为吸热反应,可知该反应的
由图可知,升高温度正反应速率大于逆反应速率,平衡正向移动,为吸热反应,可知该反应的![]() ,故A错误;
,故A错误;
B.加入少量KCl晶体,不影响平衡移动,反应速率不变,与图象不符,故B错误;
C.为气体体积不变的反应,增大压强反应速率增大,平衡不移动,与图象一致,故C正确;
D.加入B时促进A的转化,则A的转化率增大,且为气体体积不变的反应,增大压强平衡不移动转化率不变,与图象不符,故D错误;
故选:C。

【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.软锰矿(MnO2)、菱锰矿(MnCO3)吸收烧结烟气中的SO2制取硫酸锰。pH值对SO2吸收率的影响如图所示。在吸收过程中,氧气溶解在矿浆中将 H2SO3氧化成硫酸。

(1)SO2的吸收率在pH=_____效果最佳,MnO2所起的作用是_______,菱锰矿作为调控剂与硫酸反应, 确保pH的稳定,该反应的化学方程式为___________。
Ⅱ.沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

(2)CO转化反应的平衡常数K(a)____K(c)(填“>”“<”或“=”,下同),在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率___α型,e点转化率出现突变的原因可能是______。
Ⅲ.N2H4是一种具有强还原性的物质。燃烧过程中释放的能量如下:(已知a>b)
① N2H4(g)+2O2(g) == NO2(g)+1/2N2(g)+2H2O(g) ΔH1=a kJ·mol-1
② N2H4(g)+2O2(g) == 2NO(g)+2H2O(g) ΔH2=b kJ·mol-1
(3)已知反应活化能越低,反应速率越大。假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。


(4)试写出NO(g)分解生成N2(g)和NO2(g)的热化学方程式为_____________。
Ⅳ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如下图所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525mol CO2,则Y的化学式为_____。实验过程中不采用NO2的模拟NOx原因是_________。