题目内容
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)写出Ti基态原子的电子排布 。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C B(选填“>”“<”),第一电离能N>O,原因是 。
(3)月球岩石·玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO2—4的空间构型为 ,其中硫原子采用 杂化,氧原子的价电子排布图为 ,任意写出一种SO2—4的等电子体 。
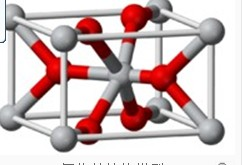
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示 。则该氧化物的化学式 (图中钛原子用“O”表示。氧原子用“O”表示)
。则该氧化物的化学式 (图中钛原子用“O”表示。氧原子用“O”表示)
(8分,每空1分)(1)1s22s22p63s23p63d24s2
(2)>;N原子中2p轨道处于半充满状态比较稳定,故第一电离能N>O
(3)正四面体形;sp3;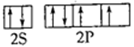 ;ClO4-或S2O32-或PO43- (4)TiO2
;ClO4-或S2O32-或PO43- (4)TiO2
【解析】
试题分析:(1)Ti的原子序数是22,所以根据构造原理可知Ti基态原子的电子排布是1s22s22p63s23p63d24s2。
(2)非金属性越强,电负性越大。碳元素的非金属性强于B的,所以碳的电负性强于B的;非金属性越强,第一电离能越强,但由于N原子中2p轨道电子处于半充满状态,稳定性强,所以第一电离能是N>O。
(3)根据价层电子对互斥理论可知,SO42-中中心原子S原子含有的孤对电子对数=(6+2-4×2)÷2=0,所以SO42-的空间构型为正四面体形;其中硫原子采用sp3杂化.氧原子的原子序数是8,所以根据洪特规则和泡利原理可知,其氧原子的价电子排布图为 ;原子数和价电子数分别都相等的是等电子体,所以与SO42-互为等电子体的是ClO4-或S2O32-或PO43-。
;原子数和价电子数分别都相等的是等电子体,所以与SO42-互为等电子体的是ClO4-或S2O32-或PO43-。
(4)根据晶胞的结构可知,氧原子的个数=8×=4个,钛原子的个数=8×+1=2个,因此该晶体的化学式是TiO2。
考点:考查核外电子排布;电负性与第一电离能比较;分子的空间构型、杂化轨道、等电子体以及晶体化学式的判断等

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案