题目内容
下图是元素周期表中短周期的一部分,B、C、D、F四种元素的原子核外最外层电子数之和等于C、D元素的原子序数之和。下列说法不正确的是
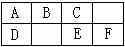
A.E元素形成的气态氢化物分子是极性分子
B.因为E元素的非金属性弱,故其氢化物的水溶液呈弱酸性
C.EF2分子中各原子的最外层均满足8电子稳定结构
D.A的单质能溶于热的E的最高价氧化物的水化物的浓溶液中
A.E元素形成的气态氢化物分子是极性分子
B.因为E元素的非金属性弱,故其氢化物的水溶液呈弱酸性
C.EF2分子中各原子的最外层均满足8电子稳定结构
D.A的单质能溶于热的E的最高价氧化物的水化物的浓溶液中
B
根据元素在周期表中的位置可知,ABC是第二周期,DEF是第三周期。设B的最外层电子数是x,则C的最外层电子数是x+1,D是x-1,F的最外层电子数是x+2。由于B是第二周期,所以B的原子序数是x+2,则C、D的原子序数是x+3,x+9,因此有x+x+1+x-1+x+2=x+3+x+9,解得x=5,则A是碳,B是氮,C是氧,D是硅,E是硫,F是氯。硫化氢是极性分子,A正确。氮的非金属性很强,氨气溶于水显碱性,所以B不正确。SCl2分子中S和Cl的化合价分别是+2价和-1价,所以最外层均满足8电子稳定结构,C正确。在加热时,碳能和浓硫酸反应生成CO2、SO2和水,D正确。答案选B。

练习册系列答案
相关题目
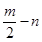 。请回答下列问题:
。请回答下列问题: