题目内容
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
【答案】D
【解析】A.Cl2分别与KI、NaBr作用生成I2、Br2,a处变蓝、b处变橙色,可证明氧化性:Cl2>I2、Cl2>Br2,无法证明I2与Br2之间氧化性的强弱,故A错误;B.氯气与水反应Cl2+H2O═H++Cl-+HClO,H+使试纸变红,HClO具有漂白性,可使试纸褪色,则c处先变红,后褪色,能证明氯气与水生成了酸性物质和漂白性物质,故B错误;C.Cl2和氢氧化钠反应生成氯化钠、次氯酸钠和水,消耗了氢氧化钠红色退去,不能证明生成物质具有漂白性,故C错误;D.Cl2将Fe2+氧化为Fe3+,试纸变为红色,反应的离子方程式2Fe2++Cl2═2Fe3++2Cl-;Fe3++3SCN-═Fe(SCN)3,证明还原性Fe2+>Cl-,故D正确;故选D。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第________周期,第______族;
(2)X可形成双原子分子,其分子的电子式是_________;Y和氢元素形成的10电子微粒中常见+1价阳离子为_______(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式__________。
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式_________________________。
(4)将0.20molYZ2和0.10molO2充入一个固定容积为5L的密闭容器中,在一定温度并有催化剂存在下,进行反应,经半分钟达到平衡,测得溶液中含YZ30.18mol,则v(O2)=________mol/(L·min);若温度不变,继续通入0.20molYZ2和0.10molO2,则平衡_______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(YZ3)<_______mol。
【题目】硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:
2SO2(g)+O2(g) ![]() 2SO3(g)。
2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是________。
SO2 压强 转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(2)反应2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2mol SO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。2.0 molSO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”), B点的化学平衡常数是______。

(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2, t1时刻达到平衡,测得容器中含SO30.18mol。
① tl 时刻达到平衡后,改变一个条件使化学反应速率发生如图所示的变化,则改变的条件是________。
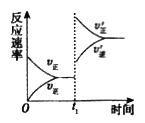
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
② 若继续通入0.20mol SO2和0.10molO2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”) ,再次达到平衡后,______mol3)<______mol。
【题目】【化学──物质结构与性质】(15分)某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应)。

(1)用A、B、O表示这类特殊晶体的化学式 。在图中,与A原子配位的氧原子数目为 。
(2)基态Cr原子的核外电子排布式为 ,其中电子的运动状态有 种。
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2,N和O的基态原子中,未成对的电子数目比为 。
(4)下表是几种碳酸盐的热分解温度和阳离子半径
碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 900 | 1172 | 1360 |
阳离子半径/pm | 99 | 112 | 135 |
请解释碳酸钙热分解温度最低的原因:___________________________________。
(5)用晶体的X射线衍射法可以测得阿伏伽德罗常数。对金属钙的测定得到以下结果:晶胞为面心立方最密堆积,边长为558pm。又知钙的密度为1.54g·cm-3,则1cm3钙晶体中含有 个晶胞,阿伏伽德罗常数为 (列式计算)。

