题目内容
【题目】可逆反应2SO2(g)+O2 (g)![]() 2SO3 (g),根据下表中的数据判断下列图像错误的是
2SO3 (g),根据下表中的数据判断下列图像错误的是


【答案】C
【解析】
试题分析:由表中数据可知,相同压强下,温度越高SO2转化率越低,说明升高温度平衡向逆反应移动,该反应正反应为放热反应;该反应正反应是体积减小的反应,相同温度下,增大压强平衡向正反应移动,由表中数据可知,压强为P2(Mpa)时SO2转化率更大,故压强P2>P1,A.温度越高,反应速率越快,到达平衡的时间越短,温度越高SO2转化率越低,图象与实际相符合,故A正确;B.该反应正反应是放热反应,升高温度,平衡向逆反应移动,SO3含量降低,增大压强,平衡正反应移动,SO3含量增大,图象与实际相符合,故B正确;C.增大压强,正、逆反应速率都增大,平衡向正反应方向移动,正反应速率增大更多,图象与实际不相符,故C错误;D.升高温度,正、逆反应速率都增大,平衡向逆反应方向移动,逆反应速率增大更多,图象与实际相符,故D正确;故选C。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:
物质 | BaSO4 | BaCO3 | AgI | AgCl | |
溶解度/g(20℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |
(1)探究BaCO3和BaSO4之间的转化
实验操作:
试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
实验Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
① 实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,______。
② 实验Ⅱ中加入稀盐酸后发生反应的离子方程式是______。
③ 实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:______。
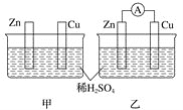
(2)探究AgCl和AgI之间的转化
实验Ⅲ:
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
装置 | 步骤 | 电压表读数 | |
| ⅰ.如图连接装置并加入试剂,闭合K | a | |
ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | ||
ⅲ.再向B中投入一定量NaCl (s) | c | ||
ⅳ.重复ⅰ,再向B中加入与ⅲ等量NaCl(s) | a |
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
① 实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是______(填序号)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是______。
③ 结合信息,解释实验Ⅳ中b<a的原因:______。
④ 实验Ⅳ的现象能说明AgI转化为AgCl,理由是______。
(3)综合实验Ⅰ~Ⅳ,可得出结论: ______。