题目内容
【题目】已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
①加少量烧碱固体 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.②③ C.③④ D.②④
【答案】D
【解析】
试题分析:①加入烧碱溶液,反应生成CH3COO-,c(H+)减小,促进CH3COOH的电离,则比值减小,故错误;②弱电解质的电离为吸热过程,加热促进电离,则比值增大,故正确;③加少量冰醋酸,醋酸浓度增大,弱电解质的浓度越大,电离程度越小,则比值减小,故错误;④加水,溶液体积增大,导致氢离子、醋酸浓度都减小,但是电离平衡:CH3COOHCH3COO-+H+正向移动,氢离子浓度减的少,醋酸浓度减的大,所以比值增大,故正确;故选D。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】利用下图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是
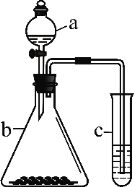
选项 | a | b | c | c试管中现象 |
A | 浓盐酸 | KMnO4 | FeCl2溶液 | 溶液变棕黄色 |
B | 稀硫酸 | Na2S2O3 | 溴水 | 产生浅黄色沉淀 |
C | 硼酸 | Na2CO3 | Na2SiO3溶液 | 析出白色沉淀 |
D | 浓硝酸 | 铁片 | KI-淀粉溶液 | 溶液变蓝色 |
A. A B. B C. C D. D
【题目】N2O5在一定温度下可发生下列反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。T1温度下的部分实验数据为:
4NO2(g)+O2(g) ΔH>0。T1温度下的部分实验数据为:
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol/ L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A. 500 s内N2O5分解速率为2.96×10-3mol/(L·s)
B. T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
