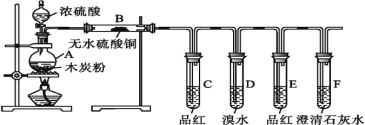
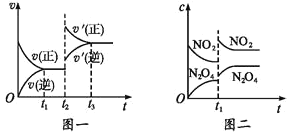
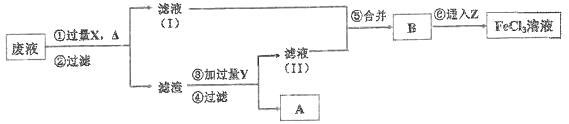
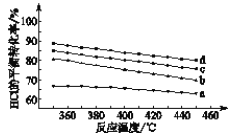
题目内容
【题目】我们祖先的四大发明之一黑火药的爆炸反应为:S+2KNO3+3C![]() A+N2↑+3CO2↑(已配平)。请回答下列问题:
A+N2↑+3CO2↑(已配平)。请回答下列问题:
(1)生成物固体A属于___________晶体,上述化学反应的氧化剂是__________(写化学式);
(2)硫元素在周期表中的位置为_________能说明氯的非金属性比硫强的实验是_______(任写一条即可);
(3)C原子最外层电子的电子排布式是_____,CCl4是一种常见的有机溶剂,写出其电子式_____,判断其属于_________(填“极性”、“非极性”)共价键_____分子(填“极性”或“非极性”)。
【答案】离子 S、KNO3 第三周期第ⅥA族 Cl2+H2S=2HCl+S↓ 2s22p2 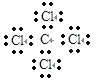 极性 非极性
极性 非极性
【解析】
S+2KNO3+3C![]() A+N2↑+3CO2↑,根据质量守恒,可知A为硫化钾(K2S)。
A+N2↑+3CO2↑,根据质量守恒,可知A为硫化钾(K2S)。
(1)生成物固体A是硫化钾属于离子晶体,上述化学反应中氮元素、硫元素的化合价降低,所以氧化剂是S、KNO3,
故答案为:离子;S、KNO3;
(2)硫元素在周期表中的位置为第三周期第ⅥA族,同周期从左至右非金属性增强,非金属性S<Cl,可以利用氯气与硫化氢反应生成S验证,反应方程式为:Cl2+H2S=2HCl+S↓;
故答案为:第三周期第ⅥA族;Cl2+H2S=2HCl+S↓;
(3)C原子最外层电子的电子排布式是2s22p2;四氯化碳中碳原子和氯原子均满足8电子稳定结构,正确的电子式为 ,不同原子形成的共价键是极性共价键;CCl4是正四面体结构,正负电荷中心重合,所以CCl4是极性共价键形成的非极性分子,
,不同原子形成的共价键是极性共价键;CCl4是正四面体结构,正负电荷中心重合,所以CCl4是极性共价键形成的非极性分子,
故答案为:2s22p2; ;极性;非极性。
;极性;非极性。

练习册系列答案
相关题目