题目内容
(2008?闵行区模拟)氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如下:

依据上图,完成下列问题:
(1)写出电解饱和食盐水的离子方程式:
(2)粗盐常含Ca2+、Mg2+、SO42-等杂离子,精制过程中要将它们以沉淀的形式除去,则加入试剂的合理顺序为
A.先加入NaOH,后加入Na2CO3,再加入BaCl2溶液
B.先加入NaOH,后加入BaCl2溶液,再加入Na2CO3
C.先加入BaCl2溶液,后加入NaOH,再加入Na2CO3
(3)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过
(4)由图示可知在电解制碱过程中
(5)如图所示,目前电解法制烧碱通常采用离子交换膜法,阳离子交换膜不允许阴离子通过,阴离子交换膜不允许阳离子通过.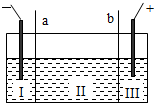 则以下叙述正确的是
则以下叙述正确的是
A.NaOH、H2均在Ⅰ区产生
B.图中a为阴离子交换膜,b为阳离子交换膜
C.Ⅲ区炭棒上的电极反应式为 2Cl--2e→Cl2↑
D.取少量Ⅲ区中的溶液,滴加酚酞,溶液变红色
(6)在实际生产中,经过脱盐后得到含溶质质量分数约为50%的NaOH溶液(密度为1.92g/cm3),则该烧碱溶液的物质的量浓度为

依据上图,完成下列问题:
(1)写出电解饱和食盐水的离子方程式:
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
(2)粗盐常含Ca2+、Mg2+、SO42-等杂离子,精制过程中要将它们以沉淀的形式除去,则加入试剂的合理顺序为
BC
BC
(填编号).A.先加入NaOH,后加入Na2CO3,再加入BaCl2溶液
B.先加入NaOH,后加入BaCl2溶液,再加入Na2CO3
C.先加入BaCl2溶液,后加入NaOH,再加入Na2CO3
(3)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过
蒸发浓缩
蒸发浓缩
(填写操作名称)、冷却结晶、过滤
过滤
(填写操作名称),除去NaCl.(4)由图示可知在电解制碱过程中
NaCl
NaCl
可以循环使用,以提高反应物利用率;在制碱的同时,还产生H2和Cl2,工业上常常利用它们生产盐酸(或HCl)
盐酸(或HCl)
.(5)如图所示,目前电解法制烧碱通常采用离子交换膜法,阳离子交换膜不允许阴离子通过,阴离子交换膜不允许阳离子通过.
 则以下叙述正确的是
则以下叙述正确的是AC
AC
(填编号).A.NaOH、H2均在Ⅰ区产生
B.图中a为阴离子交换膜,b为阳离子交换膜
C.Ⅲ区炭棒上的电极反应式为 2Cl--2e→Cl2↑
D.取少量Ⅲ区中的溶液,滴加酚酞,溶液变红色
(6)在实际生产中,经过脱盐后得到含溶质质量分数约为50%的NaOH溶液(密度为1.92g/cm3),则该烧碱溶液的物质的量浓度为
24.0mol/L
24.0mol/L
.分析:(1)根据图可看出电解氯化钠溶液的生成物,配平即可;
(2)根据除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去进行分析;
(3)根据氯化钠的溶解度随温度变化不大的特征进行分析;
(4)根据循环图寻找可以循环使用的物质,工业上可以用氯气和氢气反应生成氯化氢来生产盐酸;
(5)根据电解的工作原理:阳极放电的是氯离子,阴极放电的是氢离子来分析;
(6)根据质量分数和物质的量浓度间的关系c=
来计算.
(2)根据除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去进行分析;
(3)根据氯化钠的溶解度随温度变化不大的特征进行分析;
(4)根据循环图寻找可以循环使用的物质,工业上可以用氯气和氢气反应生成氯化氢来生产盐酸;
(5)根据电解的工作原理:阳极放电的是氯离子,阴极放电的是氢离子来分析;
(6)根据质量分数和物质的量浓度间的关系c=
| 1000ρw% |
| M |
解答:解:(1)电解氯化钠溶液的生成物是氢氧化钠、氯气和氢气,即:2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;
(2)根据除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去,加入Na2CO3的顺序必须在加入钡离子的后面即可,分析四个选项可知BC符合题意.
故答案为:BC;
(3)因为氯化钠的溶解度随温度变化不大,所以可以采用蒸发溶剂结晶的方法,除去氢氧化钠中的氯化钠,故答案为:蒸发浓缩;过滤;
(4)根据循环图,可以循环使用的物质是氯化钠,工业上可以用氯气和氢气反应生成氯化氢来生产盐酸,故答案为:NaCl;盐酸;
(5)A、根据电解的工作原理:阳极放电的是氯离子,生成氯气,阴极放电的是氢离子,生成氢气,氢氧根和钠离子结合生成氢氧化钠,故A正确;
B、图中Ⅰ区产生了氢氧化钠,是氢离子放电的电极区域,钠离子可以通过a,所以a为阳离子交换膜,b为阴离子交换膜,故B错误;
C、Ⅲ区炭棒是阳极,该极上的电极反应式为 2Cl--2e→Cl2↑,故C正确;
D、Ⅲ区中生成的是氯气,和水反应生成盐酸和次氯酸,溶液显酸性,该溶液滴加酚酞,溶液无色,故D错误.
故选AC;
(6)质量分数和物质的量浓度间的关系c=
,所以该烧碱溶液的物质的量浓度C=
=24.0mol/L.
故答案为:24.0mol/L.
| ||
| ||
(2)根据除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去,加入Na2CO3的顺序必须在加入钡离子的后面即可,分析四个选项可知BC符合题意.
故答案为:BC;
(3)因为氯化钠的溶解度随温度变化不大,所以可以采用蒸发溶剂结晶的方法,除去氢氧化钠中的氯化钠,故答案为:蒸发浓缩;过滤;
(4)根据循环图,可以循环使用的物质是氯化钠,工业上可以用氯气和氢气反应生成氯化氢来生产盐酸,故答案为:NaCl;盐酸;
(5)A、根据电解的工作原理:阳极放电的是氯离子,生成氯气,阴极放电的是氢离子,生成氢气,氢氧根和钠离子结合生成氢氧化钠,故A正确;
B、图中Ⅰ区产生了氢氧化钠,是氢离子放电的电极区域,钠离子可以通过a,所以a为阳离子交换膜,b为阴离子交换膜,故B错误;
C、Ⅲ区炭棒是阳极,该极上的电极反应式为 2Cl--2e→Cl2↑,故C正确;
D、Ⅲ区中生成的是氯气,和水反应生成盐酸和次氯酸,溶液显酸性,该溶液滴加酚酞,溶液无色,故D错误.
故选AC;
(6)质量分数和物质的量浓度间的关系c=
| 1000ρw% |
| M |
| 1000×1.92g/ml×50% |
| 40g/mol |
故答案为:24.0mol/L.
点评:本题是一道综合性试题,涉及知识点比较多,要求学生有完整的知识结构和分析问题的能力.

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目





 ;
;