题目内容
某氨水中c(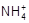 )=0.5 mol / L时达到电离平衡,若向其中加入c(
)=0.5 mol / L时达到电离平衡,若向其中加入c(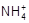 )=0.5 mol / L的NH4Cl溶液后,NH3·H2O的电离程度将 ( )
)=0.5 mol / L的NH4Cl溶液后,NH3·H2O的电离程度将 ( )
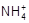 )=0.5 mol / L时达到电离平衡,若向其中加入c(
)=0.5 mol / L时达到电离平衡,若向其中加入c(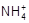 )=0.5 mol / L的NH4Cl溶液后,NH3·H2O的电离程度将 ( )
)=0.5 mol / L的NH4Cl溶液后,NH3·H2O的电离程度将 ( )| A.减少 | B.不变 | C.增大 | D.无法判断 |
C
正确答案:C
加入c(
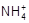 )=0.5 mol / L的NH4Cl溶液后,NH3·H2O的体积扩大一倍,NH3·H2O的平衡向电离方向移动,NH3·H2O的电离程度将境大。
)=0.5 mol / L的NH4Cl溶液后,NH3·H2O的体积扩大一倍,NH3·H2O的平衡向电离方向移动,NH3·H2O的电离程度将境大。
练习册系列答案
相关题目
 _____,B1__________,B2__________;
_____,B1__________,B2__________;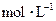 的
的 溶液中离子浓度大小排序 ________________;
溶液中离子浓度大小排序 ________________; CH3COO— +H+ 对于该平衡,下列叙述正确的是( )
CH3COO— +H+ 对于该平衡,下列叙述正确的是( ) CH3COO-+H+达到平衡时,若要使醋酸的电离程度和溶液的pH都增大,应加入的试剂是
CH3COO-+H+达到平衡时,若要使醋酸的电离程度和溶液的pH都增大,应加入的试剂是 H++SO
H++SO COOH
COOH CH3COO-+H+
CH3COO-+H+