题目内容
下列实验操作与对应的反应现象或原理正确的一组是( )
| 选项 | 实验操作 | 现象或原理 |
| A | 取少量KI溶液,先滴加氯水,再加入少量苯,振荡、静置 | 溶液分层,下层呈紫红色 |
| B | 将稀盐酸或氢氧化钠溶液慢慢滴入氢氧化铝胶体中 | 均先沉淀后溶解 |
| C | 将浓硝酸加入盛有铂、金的烧杯中,不反应,加入一定量浓盐酸后,铂、金溶解 | 浓盐酸氧化性强于浓硝酸 |
| D | 将40.0 g NaOH固体溶于1.0 L蒸馏水中配成溶液 | 溶液物质的量浓度为1.0mol﹒L-1 |
B
解析试题分析:A.发生反应:Cl2+2I-=I2+2Cl-。I2容易溶解在苯等有机溶剂中,而苯的密度比水小,难溶于水,所以再加入少量苯,振荡、静置,会看到溶液分层,上层呈紫红色。错误。B. 胶体的表面积大,能吸附电荷。金属氢氧化物的胶体吸附正电荷。胶粒之间有排除力,所以胶体能稳定存在。当向胶体中加入电解质时,胶粒上的电荷被中和发生聚沉现象。若向其中加入稀盐酸或氢氧化钠溶液,由于氢氧化铝是两性氢氧化物,既能与强酸发生反应,也能与强碱发生反应,产物都容易溶解在水中,所以,均先沉淀后溶解现象。正确。C. 将浓硝酸加入盛有铂、金的烧杯中,不反应,加入一定量浓盐酸后,形成王水,能产生新的强氧化剂,所以能够将铂、金溶解。不是浓盐酸氧化性强于浓硝酸。错误。D.溶液的物质的量浓度是用位体积的溶液中溶质的物质的量的多少来表示溶液组成的物理量。不是指溶剂的体积。错误。
考点:考查卤素单质的溶解性、胶体、王水的性质及物质的量浓度的含义的知识。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
以下仪器中,可以不在室温下使用的是
| A.漏斗 | B.量筒 | C.移液管 | D.滴定管 |
下列叙述合理的是
| A.用溴的四氯化碳溶液除去甲烷中混有的少量乙烯气体 |
| B.向淀粉溶液中加入稀硫酸,加热几分钟,冷却后再加入少量新制Cu(OH)2浊液,加热, 没有红色沉淀生成,说明淀粉还没有发生水解 |
| C.用硝酸酸化的AgNO3溶液检验否含有氯元素 |
| D.红热的铜丝可以和乙醇发生置换反应产生氢气 |
下列各图所表示的实验原理、方法、装置和操作正确的是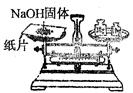
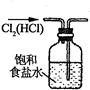
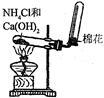
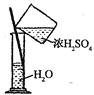
| A.称取NaOH | B.除去Cl2中少量HCl | C.制取氨气 | D.稀释浓H2SO4 |
下列说法不正确的是 ( )
| A.使用滴定管时,滴定管必须用待装液润洗2~3次 |
| B.滴定操作中,若用待测液润洗锥形瓶,将导致测定结果偏高 |
| C.用10 mL的量筒量取8.58 mL 0.10 mol·L-1的稀盐酸 |
| D.稀释浓硫酸时,将浓硫酸缓缓加入水中,并不断用玻璃棒搅拌 |
下列实验操作完全正确的是( )
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000 mL | 准确称取氯化钾固体,放入到1000 mL的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
下列实验现象及相关结论均正确的是( )
| | A | B | C | D |
| 实验 |  |  |  |  |
| 现象 | 品红褪色 | 最后试管有浅黄色沉淀 | 最后一滴标准液使酚酞由无色变为红色,且30s内不复原 | 盐桥左端从无色逐渐变为蓝色 |
| 结论 | SO2有 | | | |
| 强氧化性 | 有机物中含有溴原子 | 滴定达到终点 | 金属Ⅱ比Ⅰ活泼 | |
下列实验操作会引起测定结果偏低的是( )
| A.用量筒量取8.2 mL某溶液时俯视读数 |
| B.中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释 |
| C.测定一包白色粉末的质量,将药品放在右盘,砝码放在左盘,并移动游码使之平衡 |
| D.配制0.1 mol/L的NaOH溶液100 mL,未经冷却即注入容量瓶定容 |
下列实验操作正确的是( )
| A.测定某浓度盐酸的pH时,先将pH试纸用蒸馏水湿润 |
| B.容量瓶用蒸馏水洗净,必须烘干后才能用于溶液的配制 |
| C.用苯萃取溴水中的溴之后进行分液时,水层从分液漏斗的下口放出 |
| D.中和滴定时,锥形瓶需要用待测液润洗后才能使用 |