��Ŀ����
����Ŀ��������Ԫ��Q��R��T��W��Ԫ�����ڱ���λ����ͼ��ʾ������T��������������������������ȣ� ��ش��������⣺
��1��T��ԭ�ӽṹʾ��ͼΪ �� R������⻯��ĵ���ʽΪ �� Q��1��1���⻯������Է���������С�ķ������ͷ��ӣ����幹�ͣ���
��2��Ԫ�صķǽ�����Ϊ��ԭ�ӵĵõ�����������QW���ǿ�ڡ������ڡ�����
��3��W�ĵ�����������������ˮ����Ũ��Һ�����ܷ�����Ӧ�������������ʣ�����һ�������壬��Ӧ�Ļ�ѧ����ʽΪ ��
��4��R�ж���������������������Է���������С����һ�������£�2L�ļ�������0.5L���������ϣ����û�����屻������NaOH��Һ��ȫ���պ�û����������������ɵ�R�ĺ������εĻ�ѧʽ�� ��
���𰸡�
��1��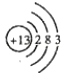 ��
��![]() ��ֱ��
��ֱ��
��2������
��3��S+2H2SO4��Ũ�� ![]() 3SO2+2H2O
3SO2+2H2O
��4��NaNO2
���������⣺�ɶ�����Ԫ��Q��R��T��W������λ�ã���ȷ��T��WΪ�������ڵ�Ԫ�أ�Q��RΪ�ڶ�����Ԫ�أ�T������������������������ȣ���TΪAlԪ�أ���QΪCԪ�أ�RΪNԪ�أ�WΪSԪ�أ���1��T��ΪAl��ԭ�Ӻ�����3�����Ӳ㣬���������Ϊ2��8��3��Al��ԭ�ӽṹʾ��ͼΪ 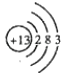 ��R������⻯��Ϊ�����������ʽΪ
��R������⻯��Ϊ�����������ʽΪ ![]() ��Q��1��1���⻯������Է���������С�ķ���ΪCH��CH��CΪsp�ӻ���Ϊֱ�߷��ӣ����Դ��ǣ�
��Q��1��1���⻯������Է���������С�ķ���ΪCH��CH��CΪsp�ӻ���Ϊֱ�߷��ӣ����Դ��ǣ�  ��
�� ![]() ��ֱ�ߣ���2����������Դ���̼������ԣ��ɱȽϷǽ�����Q��W�����Դ��ǣ����ڣ���3��WΪS��������������ˮ����Ũ��ҺΪŨ���ᣬ���߷�Ӧ���ɶ��������ˮ���÷�Ӧ�Ļ�ѧ����ʽΪS+2H2SO4��Ũ��
��ֱ�ߣ���2����������Դ���̼������ԣ��ɱȽϷǽ�����Q��W�����Դ��ǣ����ڣ���3��WΪS��������������ˮ����Ũ��ҺΪŨ���ᣬ���߷�Ӧ���ɶ��������ˮ���÷�Ӧ�Ļ�ѧ����ʽΪS+2H2SO4��Ũ�� ![]() 3SO2+2H2O�� ���Դ��ǣ�S+2H2SO4��Ũ��
3SO2+2H2O�� ���Դ��ǣ�S+2H2SO4��Ũ�� ![]() 3SO2+2H2O����4��RΪNԪ�أ��ж�����������м���Է���������С�����ΪNO����һ�������£�2L�ļ�������0.5L���������ϣ����û�����屻������NaOH��Һ��ȫ���պ�û�����������������������NԪ�ػ��ϼ�Ϊa�����ݵ���ת���غ㣺2��a��2��=0.5��4�����a=3�������ɵ�R�ĺ������εĻ�ѧʽ��NaNO2 �� ���Դ��ǣ�NaNO2 ��
3SO2+2H2O����4��RΪNԪ�أ��ж�����������м���Է���������С�����ΪNO����һ�������£�2L�ļ�������0.5L���������ϣ����û�����屻������NaOH��Һ��ȫ���պ�û�����������������������NԪ�ػ��ϼ�Ϊa�����ݵ���ת���غ㣺2��a��2��=0.5��4�����a=3�������ɵ�R�ĺ������εĻ�ѧʽ��NaNO2 �� ���Դ��ǣ�NaNO2 ��

 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�����Ŀ��Ԫ�����ڱ���Ԫ����������ѧϰ���о�������ʵ���ж��зdz���Ҫ�����á��±���Ԫ�����ڱ�ǰ�����ڵ�һ���֣��г��ˢ���������Ԫ�������ڱ��е�λ�á�
�� | �� | �� | |||
�� | �� | �� | �� |
��ش�
��1����������Ԫ�ص�����Ϊ______
��2������Ԫ���У��ǽ�������ǿ��Ԫ����______(��Ԫ�ط���)������������ˮ����������ǿ����_______(�ѧʽ)����������ϼ���������ϼ۵Ĵ�����Ϊ4��Ԫ����_______(��Ԫ�ط���)��
��3����������������ӦԪ����ԭ�Ӱ뾶��С����______(��Ԫ�ط���)�������Ӱ뾶������______(�����ӷ���)��