题目内容
在一定温度下将2 mol A和2 mol B两种气体混合于某2L密闭容器中,发生如下反应:3A(g)+B(g) 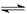 2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
2C(g)+2D(g),2 min末反应达到平衡状态,生成了0.8 mol D,请填写下列空白:
(1)如果缩小反应容器的体积,使压强增大,平衡体系中C的物质的量浓度_____________,C的质量分数___________,容器内气体的平均密度________________,平均相对分子质量________________。(填“增大”、“减小”或“不变”)
(2)如果上述反应在相同条件下从逆反应开始进行,开始加C和D各4/3mol,要使平衡时各物质的物质的量与原平衡相等,则还应加入__________物质___________mol。
(1)增大 不变 增大 不变 (2)B 
【解析】
试题分析:(1)根据方程式可知,反应前后气体体积是不变的,所以如果缩小反应容器的体积,使压强增大,平衡不移动,但C的浓度是增大的。而C的质量分数不变。密度是混合气的质量和容器容积的比值,混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,由于容器减小,平衡不移动,所以混合气的密度增大,而混合气的平均相对分子质量不变。
(2)C和D各4/3mol,则相当于A和B的物质的量分别是2 mol A和2/3 mol B。由于是温度和容积是不变的,所以要满足平衡等效,对应各物质起始投料的物质的量与原平衡起始态相同,所以还缺少B物质,其物质的量是(2mol-2/3mol)=4/3mol。
考点:考查外界条件对平衡状态的影响以及等效平衡的有关计算
点评:在进行等效平衡的有关计算时关键是分清类别,用相应的方法求解即可。

 HCO3-+OH-
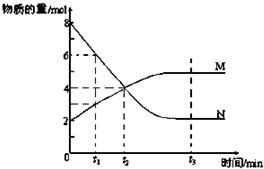
HCO3-+OH-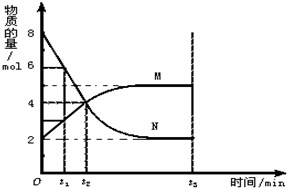 在一定温度下,在容积为2L的容器内,某反应各物质(均为气体)的物质的量随反应时间的变化曲线如图,试回答下列问题:
在一定温度下,在容积为2L的容器内,某反应各物质(均为气体)的物质的量随反应时间的变化曲线如图,试回答下列问题: M
M
 (1)1mol O2与足量氢气反应产生水蒸气放热483.6kJ,若1g水蒸气转化成液态水放热2.444kJ,请写出表示氢气燃烧热的热化学方程式:
(1)1mol O2与足量氢气反应产生水蒸气放热483.6kJ,若1g水蒸气转化成液态水放热2.444kJ,请写出表示氢气燃烧热的热化学方程式: