题目内容
(15分)铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。

①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为 。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。

①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为 。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g)
 Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
⑴①吸氧腐蚀 ②B
⑵①4HNO3
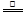 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O②4Fe+10HNO3=4 Fe(NO3)2+NH4NO3+3H2O
③氮氧化物排放少(或其他合理答案)
⑶①4:1 ②0.05
试题分析:⑴①钢铁在海水(中性环境)中发生的应该是吸氧腐蚀。
②在B点的海水中氧气浓度最大,发生的吸氧腐蚀最快,生成的铁锈最多。
⑵①硝酸受热分解产生NO2、O2、H2O,通过氧化还原反应的化合价升降法将其配平。
②通过示意图分析,确定HNO3与Fe该反应的生成物除了Fe(NO3)2还有NH4NO3,先根据得失电子守恒有4Fe+10HNO3--4 Fe(NO3)2+ NH4NO3,再根据原子守恒得4Fe+10HNO3=4 Fe(NO3)2+ NH4NO3+3H2O。
③该生产流程中生成了NH4NO3,没有产生NO、NO2等有毒气体,减少了氮氧化物的排放量,符号“绿色化学”思想。
⑶①据题意有K=
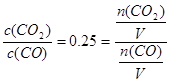 ,则n(CO):n(CO2)=4:1。
,则n(CO):n(CO2)=4:1。②据题意有n(CO):n(CO2)=(x-0.01):0.01=4:1,解得x=0.05 mol。

练习册系列答案
相关题目
 ( )
( ) FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。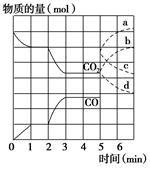
 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
 2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表: 2NO2(g),其化学平衡常数K和温度t的关系如下表:
2NO2(g),其化学平衡常数K和温度t的关系如下表: