题目内容
8.如图是依据各种元素(原子)的性质与原子序数(1~20)的关系而作出的,各图的纵轴可能代表下列某一性质:核电荷数、中子数、最高正化合价、原子半径、得电子能力,A、B、C分别代表三种元素.(注意:图3中原子序数为8、9的元素和图4中原子序数为2、10、18的元素在纵轴上没有对应的数值)
请回答下列问题:
(1)图2纵轴代表的性质是中子数图4纵轴代表的性质是得电子能力
(2)A元素的其最低负化合价为-4.
(3)B、C两种元素形成的化合物中,C显最高正化合价而B显最低负化合价,该化合物的化学式为SiCl4.
(4)1~20号元素中,原子半径最大的是(稀有气体除外)K.
分析 (1)元素的质子数等于该元素的原子序数;原子中中子数与与质子数相近;元素的最高正价等于最外层电子数,且O、F无最高正价,稀有气体化合价为0;
从图4中,可以发现元素原子的某种性质随原子序数的递增而呈周期性变化(小→大);
(2)A的最高正价为+4价,根据正负化合价的绝对值之和等于8计算;
(3)C为+4价为Si元素,B为+7价为Cl元素;
(4)同周期从左到右原子半径依次减小,同一主族从上到下原子半径依次增大.
解答 解:(1)元素的质子数等于该元素的原子序数,则图1中纵轴表示质子数;原子中中子数与与质子数相近,则图2中纵轴表示中子数;元素的最高正价等于最外层电子数,且O、F无最高正价,稀有气体化合价为0,则图3中纵轴表示化合价;从图3中,可以发现元素原子的某种性质随原子序数的递增而呈周期性变化(小→大),故图3纵轴代表得电子能力,
故答案为:中子数;得电子能力;
(2)A的最高正价为+4价,根据正负化合价的绝对值之和等于8可知,其负价为-4价;
故答案为:-4;
(3)C为+4价为Si元素,B为+7价为Cl元素,二者形成的化合物为SiCl4;
故答案为:SiCl4;
(4)同周期从左到右原子半径依次减小,同一主族从上到下原子半径依次增大,所以1~20号元素中,原子半径最大的是(稀有气体除外)K;
故答案为:K.
点评 本题考查结构性质位置关系综合运用,难度中等,注意根据元素周期律分析图象中纵坐标随横坐标的变化关系,侧重于考查学生的读图能力和分析能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.载人宇宙飞船中用太阳能电池和氢氧燃料电池进行供电.下列相关说法错误的是( )
| A. | 制造太阳能电池的材料是单质硅 | |
| B. | 太阳能电池将光能转化为化学能 | |
| C. | 氢氧燃料电池中氢气在负极反应 | |
| D. | 碱性氢氧燃料电池中正极区有OH?生成 |
3. 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中正确的是( )
 如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中正确的是( )
如图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等.下列叙述中正确的是( )| A. | 三种元素的原子半径的大小顺序是W<Y<X | |
| B. | W最高价氧化物对应水化物是强酸,气态氢化物是弱碱 | |
| C. | X元素的氧化物水溶液呈强酸性 | |
| D. | Y元素的单质是非金属单质中唯一能跟水发生剧烈反应的单质 |
1.用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅的反应如下:3SiCl4(g)+2N2(g)+6H2(g)$\frac{\underline{\;高温\;}}{\;}$Si3N4(s)+12HCl(g)△H<0,一定温度下,恒容密闭容器中进行该反应,下列措施能增大正反应的反应速率的是( )
| A. | 分离出少量氮化硅 | B. | 降低温度 | ||
| C. | 充入氮气 | D. | 充入氦 |
8.下列叙述中,正确的是( )
| A. | 植物油和裂化汽油都能使溴水褪色 | B. | 食用植物油是人体的营养物质 | ||
| C. | 汽油、煤油、卤代烃均为烃 | D. | 甲醛可大量用作食品防腐剂 |
6.下列含有非极性键的化合物是( )
| A. | MgCl2 | B. | Na2O2 | C. | H2O | D. | CH4 |

 Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl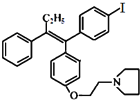 (不考虑立体结构).
(不考虑立体结构).
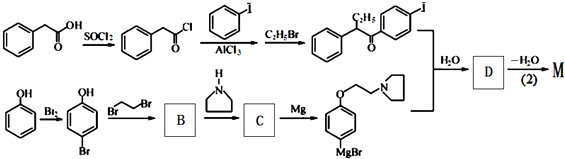


 D
D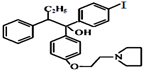
 有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有6种.
有多种同分异构体,其中满足①遇FeCl3显色②苯环上的一溴取代物只有一种,符合条件的同分异构体数目有6种. 中任一种.
中任一种. +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +HBr.
+HBr. 及含二个碳原子的有机化合物为原料,制备芳香醇
及含二个碳原子的有机化合物为原料,制备芳香醇 的合成路线
的合成路线 (不超过5步反应).
(不超过5步反应).