题目内容
HA为酸性略强于醋酸的一元弱酸,则下列叙述正确的是
- A.0. 1 mol?L-1 HA中c(H+)= c(OH-)+ c(A-)
- B.0. 1 mol?L-1 HA与 0. 1 mol?L-1NaOH 混合至溶液呈中性:c(Na+)= c(A-)
- C.0. 1 mol?L-1 NaA 中c(Na+)> c(OH-)>c(A-)> c(H+)
- D.0. 1 mol?L-1 HA中加入少量NaA固体,HA的电离常数减小
AB
试题分析:依题意,HA H++A—、H2O
H++A—、H2O H++OH—,则稀HA溶液中含有A—、OH—、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+ c(OH-) = c(H+),故A选项正确;酸碱中和反应后所得溶液中含有A—、OH—、Na+、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+c(OH-)=c(Na+)+c(H+),若溶液呈电中性,则c(A-) =c(Na+),故B选项正确;NaA=Na++A—、H2O
H++OH—,则稀HA溶液中含有A—、OH—、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+ c(OH-) = c(H+),故A选项正确;酸碱中和反应后所得溶液中含有A—、OH—、Na+、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+c(OH-)=c(Na+)+c(H+),若溶液呈电中性,则c(A-) =c(Na+),故B选项正确;NaA=Na++A—、H2O H++OH—,钠离子不能水解,少部分A—能水解生成HA,消耗水电离出的氢离子,促进水的电离,则稀盐溶液中c(Na+)>c(A-)>c(OH-)>c(H+),故C选项错误;稀HA溶液中存在电离平衡:HA
H++OH—,钠离子不能水解,少部分A—能水解生成HA,消耗水电离出的氢离子,促进水的电离,则稀盐溶液中c(Na+)>c(A-)>c(OH-)>c(H+),故C选项错误;稀HA溶液中存在电离平衡:HA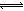 H++A—,NaA是强电解质,加入NaA固体,其完全电离出的A—增大溶液中c(A-),增大生成物浓度使弱酸电离平衡向逆反应方向移动,但HA的电离平衡常数只与温度有关,温度不变电离平衡常数不变,故D选项错误。
H++A—,NaA是强电解质,加入NaA固体,其完全电离出的A—增大溶液中c(A-),增大生成物浓度使弱酸电离平衡向逆反应方向移动,但HA的电离平衡常数只与温度有关,温度不变电离平衡常数不变,故D选项错误。
考点:考查水溶液中粒子浓度大小关系,涉及弱酸溶液或弱酸与强碱混合溶液中的电荷守恒关系式、酸性的酸碱性、盐溶液中离子浓度大小顺序、弱酸电离平衡的移动规律、弱酸电离平衡常数的影响因素及规律等。
试题分析:依题意,HA
 H++A—、H2O
H++A—、H2O H++OH—,则稀HA溶液中含有A—、OH—、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+ c(OH-) = c(H+),故A选项正确;酸碱中和反应后所得溶液中含有A—、OH—、Na+、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+c(OH-)=c(Na+)+c(H+),若溶液呈电中性,则c(A-) =c(Na+),故B选项正确;NaA=Na++A—、H2O
H++OH—,则稀HA溶液中含有A—、OH—、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+ c(OH-) = c(H+),故A选项正确;酸碱中和反应后所得溶液中含有A—、OH—、Na+、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+c(OH-)=c(Na+)+c(H+),若溶液呈电中性,则c(A-) =c(Na+),故B选项正确;NaA=Na++A—、H2O H++OH—,钠离子不能水解,少部分A—能水解生成HA,消耗水电离出的氢离子,促进水的电离,则稀盐溶液中c(Na+)>c(A-)>c(OH-)>c(H+),故C选项错误;稀HA溶液中存在电离平衡:HA
H++OH—,钠离子不能水解,少部分A—能水解生成HA,消耗水电离出的氢离子,促进水的电离,则稀盐溶液中c(Na+)>c(A-)>c(OH-)>c(H+),故C选项错误;稀HA溶液中存在电离平衡:HA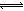 H++A—,NaA是强电解质,加入NaA固体,其完全电离出的A—增大溶液中c(A-),增大生成物浓度使弱酸电离平衡向逆反应方向移动,但HA的电离平衡常数只与温度有关,温度不变电离平衡常数不变,故D选项错误。
H++A—,NaA是强电解质,加入NaA固体,其完全电离出的A—增大溶液中c(A-),增大生成物浓度使弱酸电离平衡向逆反应方向移动,但HA的电离平衡常数只与温度有关,温度不变电离平衡常数不变,故D选项错误。考点:考查水溶液中粒子浓度大小关系,涉及弱酸溶液或弱酸与强碱混合溶液中的电荷守恒关系式、酸性的酸碱性、盐溶液中离子浓度大小顺序、弱酸电离平衡的移动规律、弱酸电离平衡常数的影响因素及规律等。

练习册系列答案
相关题目