题目内容
如图所示装置,室温下密闭容器内分别充入空气和H2.O2的混合气体在可移动的活塞两边,在标准状况下若将H2.O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2.O2的体积比最接近于 ( )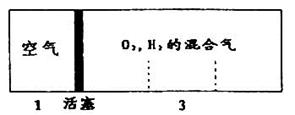
①2:7 ②5:4 ③4:5 ④7:2
| A.①② | B.②④ | C.③④ | D.①③ |
C
解析试题分析:同温同压下,气体的体积之比等于物质的量之比,设空气为1 mol,则反应前,H2与O2共3 mol,反应后剩余气体1 mol,反应的H2和O2共2mol,根据化学反应:2H2+O2=2H2O,反应的H2为4/3mol,反应的O2为2/3mol,而剩余气体可能是H2,也可能是O2。若剩余O2,则H2、O2的体积比为4/3:(2/3+1)=4:5;若剩余H2,则H2、O2的体积比为(4/3+1):2/3=7:2,故C项正确。
考点:本题考查阿伏伽德罗定律的应用、根据化学方程式的计算。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将3.52克CO2和SO2混合气体通入一定量的NaOH溶液中,气体全部与NaOH反应生成盐,将反应后的溶液减压低温蒸干后得到不含结晶水的固体,固体的质量可能为
| A.8.48克 | B.7.48克 | C.5.72克 | D.5.22克 |
下列叙述中正确的是
| A.摩尔是物质的质量的单位 | B.碳的摩尔质量为12g |
| C.阿伏加德罗常数约为6.02×1023 /mol | D.气体摩尔体积为22.4L/mol |
下列叙述正确的是
| A.H2SO4的摩尔质量是98 |
| B.等物质的量的O2和O3中所含的氧原子数相同 |
| C.等质量的CO与CO2中所含碳原子数相同 |
| D.将98g H2SO4溶解于水配成500mL溶液,所得溶液中硫酸的物质的量浓度为2 mol/L |
某氯原子的质量为a g,12C原子的质量为b g。用NA表示阿伏加德罗常数,下列说法中不正确的是
A.ng该氯原子所含的电子数为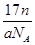 |
B.mg该氯原子的物质的量为 mol mol |
C.该氯原子的相对原子质量为 |
| D.0.5 mol该氯分子的质量为aNAg |
在体积相同的两个密闭容器中分别充满C2H4、C3H6气体,当这两个容器内温度和气体密度相等时,下列说法正确的是
| A.两种气体的压强相等 | B.C2H4比C3H6的质量小 |
| C.两种气体的分子数目相等 | D.两种气体所含的原子数目相等 |
用NA表示阿伏加德罗常数,下列有关说法正确的是
| A.在常温常压下,11.2LN2含有的分子数小于0.5NA |
| B.在常温常压下,1mol氩气含有的原子数为2NA |
| C.将1 L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA |
| D.46gNO2和N2O4混合气体所含氧原子数目有可能为3NA |
2.7g铝粉分别与体积均为100mL、浓度均为2mol/L的(1)硫酸溶液、(2)烧碱溶液、(3)盐酸完全反应,放出氢气的体积关系(相同条件)是
| A.(1)=(2)=(3) | B.(1)=(2)>(3) |
| C.(1)>(2)>(3) | D.(2)>(1)=(3) |
在标准状况下.0. 56g某气体的体积为448mL,则该气体的相对分子质量为
| A.2 | B.56 | C.14 | D.28 |