题目内容
【题目】碳、氮及其化合物在生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) ![]() 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1;
CH4(g) + 4NO(g) ![]() 2N2(g)+CO2(g) + 2H2O(g) ΔH2。
2N2(g)+CO2(g) + 2H2O(g) ΔH2。
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1 734 kJ,则ΔH2=____。
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为Fe2O3(s) + 3CH4(g)![]() 2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
2Fe(s) + 3CO(g) +6H2(g) ΔH>0。
①若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____(填字母)。
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2#)的比值不变
d.固体的总质量不变
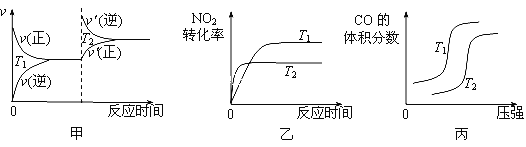
②该反应达到平衡时某物理量随温度的变化如图所示,当温度由T1升高到T2时,平衡常数KA___KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些___________。

a.H2的逆反应速率
b.CH4的体积分数
c.混合气体的平均相对分子质量
(3)若向20 mL 0.01 mol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是____(填字母)。

a.该烧碱溶液的浓度为0.02 mol·L-1
b.该烧碱溶液的浓度为0.01 mol·L-1
c.HNO2的电离平衡常数:b点>a点
d.从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
【答案】 -1160 kJ·mol-1 bd < bc bc
【解析】(1)若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1 734 kJ,热化学方程式:CH4(g) + 2NO2(g) ![]() N2(g)+CO2(g) + 2H2O(g) ΔH=-867 kJ·mol-1;由盖斯定律可得:(ΔH1+ΔH2)/2=ΔH,代入数据:(-574 kJ·mol-1+ΔH2)/2=-867 kJ·mol-1,ΔH2= -1160 kJ·mol-1。
N2(g)+CO2(g) + 2H2O(g) ΔH=-867 kJ·mol-1;由盖斯定律可得:(ΔH1+ΔH2)/2=ΔH,代入数据:(-574 kJ·mol-1+ΔH2)/2=-867 kJ·mol-1,ΔH2= -1160 kJ·mol-1。
(2)①在恒温恒压容器中反应为:Fe2O3(s) + 3CH4(g)![]() 2Fe(s) + 3CO(g) +6H2(g) ΔH>0。a.CH4的转化率等于CO的产率,表示同方向转化与生成,无法判断,a错误;b.由方程式可知,混合气体的平均相对分子质量是变量,一定条件下变量不变,说明反应达到新平衡,b正确; c.v(CO)与v(H2)的比值恒定,且没有指明方向,不能作为判断是否达到平衡的依据,c错误;d.反应前后固体的总质量是变量,一定条件下变量不变,说明反应达到新平衡,d正确;故bd正确。
2Fe(s) + 3CO(g) +6H2(g) ΔH>0。a.CH4的转化率等于CO的产率,表示同方向转化与生成,无法判断,a错误;b.由方程式可知,混合气体的平均相对分子质量是变量,一定条件下变量不变,说明反应达到新平衡,b正确; c.v(CO)与v(H2)的比值恒定,且没有指明方向,不能作为判断是否达到平衡的依据,c错误;d.反应前后固体的总质量是变量,一定条件下变量不变,说明反应达到新平衡,d正确;故bd正确。
②该反应的正反应是吸热反应,温度升高,平衡右移,由K表达式可知,KA<KB;温度升高,正、逆反应速率均增大,故a错误;温度升高,平衡右移,CH4的体积分数减小,故b正确;温度升高,平衡右移,极值分析可知,假设起始3mol气体全部为甲烷,相对分子质量为16,全部右移动生成3molCO和6molH2,平衡平均对摩尔质量=(3mol×28g/mol+6mol×2g/mol)/9mol==10.67g/mol,故c正确;选bc。
(3)由图所示,b点温度最高,说明酸碱恰好完全反应,n(HNO2)=n(NaOH),c(NaOH)= 20 mL ×0.01 mol·L-l/20 mL=0.01 mol·L-1,故a错误,b正确;由a点到b点,反应温度升高,平衡右移,电离平衡常数增大,b点电离平衡常数大于a点,故c正确;从b点到c点,可能出现c(OH-)大于c(NO2-),故d错误;选bc。

 名校课堂系列答案
名校课堂系列答案