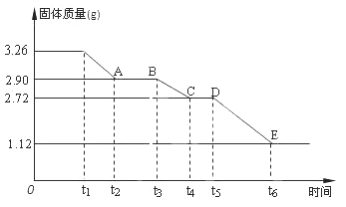
题目内容
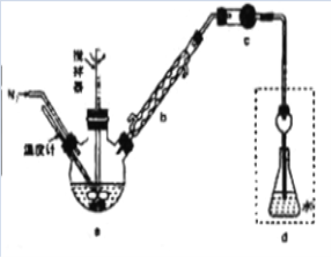
【题目】某实验兴趣小组将无水FeCl3与氯苯混合发生反应制备常用还原剂FeCl2,反应原理是:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑。按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3和225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。将生成的HCl用水吸收,利用莫尔法可以测出无水FeCl3的转化率(莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法)。
2FeCl2+C6H4Cl2+HCl↑。按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3和225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。将生成的HCl用水吸收,利用莫尔法可以测出无水FeCl3的转化率(莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法)。
已知有关数据如下:
C6H5Cl | C6H4Cl2 | |
熔点/℃ | -45 | 53 |
沸点/℃ | 132 | 173 |
回答下列问题:
(1)仪器b的作用是_______。干燥管c中盛装的试剂是________。
(2)反应结束后需向反应器a中吹入干燥的氮气,其目的是_________。
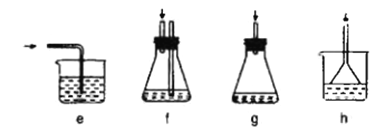
(3)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是_____(填序号)。
(4)从滤液中回收过量氯苯的操作是___________。
(5)将锥形瓶内溶液的pH调至6.0再加水稀释至1000mL,从中取10.0mL滴加几滴指示剂,用 0.2000mol/LAgNO3溶液进行滴定,当达到终点时,消耗22.50mLAgNO3溶液。
AgCl | AgBr | AgI | Ag2CrO4 | |
Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
颜色 | 白 | 淡黄 | 黄 | 砖红 |
①参照上表已知信息用硝酸银标准溶液滴定氯离子含量时可以作指示剂的是___(填字母)。
a.CaCl2 b.NaBr c.NaI d.K2CrO4
②滴定达终点的现象是_______
③无水FeC13的转化率a=_______%
【答案】 冷凝回流氯苯、导气 无水氯化钙(或五氧化二磷、硅胶) 使氯化氢全部转移至锥形瓶中被水充分吸收。准确测定FeCl3的转化率 fh 蒸馏滤液,收集132℃的馏分 d 有砖红色沉淀生成 90%
【解析】试题分析:本题考查FeCl2的制备、沉淀滴定实验、指示剂的选择和转化率的计算、溶度积的应用。
(1)C6H5Cl的沸点为132℃,制备FeCl2的反应原理为2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑,仪器b为冷凝管,仪器b的作用是:冷凝回流氯苯、导气(导出HCl气体)。干燥管c中的固体试剂不能吸收HCl,干燥管c中盛装的试剂是:无水氯化钙(或五氧化二磷、硅胶)。
2FeCl2+C6H4Cl2+HCl↑,仪器b为冷凝管,仪器b的作用是:冷凝回流氯苯、导气(导出HCl气体)。干燥管c中的固体试剂不能吸收HCl,干燥管c中盛装的试剂是:无水氯化钙(或五氧化二磷、硅胶)。
(2)根据题意,测定无水FeCl3转化率的原理是:将反应生成的HCl用水吸收,用莫尔法测定锥形瓶d中Cl-,由Cl- 计算FeCl3的转化率;为了减少实验误差,反应过程中需要将反应生成的HCl全部导入锥形瓶d中;反应结束后需向反应器a中吹入干燥的氮气,其目的是:使HCl全部转移至锥形瓶中被水充分吸收,准确测定FeCl3的转化率。
(3)虚线框内装置用于吸收HCl并防倒吸。由于HCl极易溶于水,若使用e装置会产生倒吸;f装置能吸收HCl并能防倒吸;g装置为密封装置,存在安全问题;h装置能吸收HCl并能防倒吸;能代替图中虚线框内部分的装置是f h。
(4)过滤后得到的滤液为C6H4Cl2和过量C6H5Cl的混合液,由于C6H4Cl2和C6H5Cl互相混溶且两者沸点相差较大,从滤液中回收过量氯苯采用蒸馏法,从滤液中回收过量氯苯的操作是:蒸馏滤液,收集132℃的馏分。
(5)①a项,CaCl2与AgNO3产生白色AgCl沉淀,无法判断滴定终点且影响Cl-的测定,不能用CaCl2作为指示剂;b项,AgBr、AgCl为相同类型且Ksp(AgBr)![]() Ksp(AgCl),滴入AgNO3溶液,AgBr优先于AgCl沉淀,若用NaBr为指示剂无法判断滴定终点,不能用NaBr作为指示剂;c项,AgI、AgCl为相同类型且Ksp(AgI)
Ksp(AgCl),滴入AgNO3溶液,AgBr优先于AgCl沉淀,若用NaBr为指示剂无法判断滴定终点,不能用NaBr作为指示剂;c项,AgI、AgCl为相同类型且Ksp(AgI)![]() Ksp(AgCl),滴入AgNO3溶液,AgI优先于AgCl沉淀,若用NaI为指示剂无法判断滴定终点,不能用NaI作为指示剂;d项,AgCl饱和溶液物质的量浓度=
Ksp(AgCl),滴入AgNO3溶液,AgI优先于AgCl沉淀,若用NaI为指示剂无法判断滴定终点,不能用NaI作为指示剂;d项,AgCl饱和溶液物质的量浓度=![]() =
=![]() =1.414
=1.414![]() 10-5(mol/L),Ag2CrO4饱和溶液物质的量浓度=
10-5(mol/L),Ag2CrO4饱和溶液物质的量浓度=![]() =
=![]() =7.937
=7.937![]() 10-5(mol/L)
10-5(mol/L)![]() 1.414
1.414![]() 10-5(mol/L),滴入AgNO3溶液,AgCl优先于Ag2CrO4沉淀,可用K2CrO4作指示剂;可作为指示剂的是K2CrO4,答案选d。
10-5(mol/L),滴入AgNO3溶液,AgCl优先于Ag2CrO4沉淀,可用K2CrO4作指示剂;可作为指示剂的是K2CrO4,答案选d。
②选用K2CrO4作指示剂,当Cl-完全沉淀,滴入AgNO3溶液与Kspan>2CrO4形成砖红色沉淀。滴定达终点的现象是:滴入最后一滴AgNO3溶液,有砖红色沉淀生成。
③10.0mL溶液中含Cl-物质的量n(Cl-)=n(AgNO3)=0.2000mol/L![]() 0.02250L=0.0045mol;反应生成HCl物质的量n(HCl)=0.0045mol
0.02250L=0.0045mol;反应生成HCl物质的量n(HCl)=0.0045mol![]() =0.45mol,根据反应方程式2FeCl3+C6H5Cl
=0.45mol,根据反应方程式2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑,反应消耗n(FeCl3)=2n(HCl)=0.9mol,反应消耗m(FeCl3)=0.9mol
2FeCl2+C6H4Cl2+HCl↑,反应消耗n(FeCl3)=2n(HCl)=0.9mol,反应消耗m(FeCl3)=0.9mol![]() 162.5g/mol=146.25g,无水FeCl3的转化率为
162.5g/mol=146.25g,无水FeCl3的转化率为![]() 100%=90%。
100%=90%。

【题目】
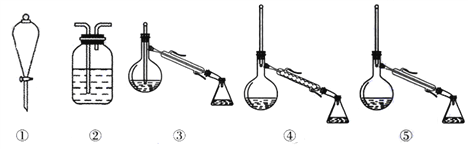
(1)在图所示仪器中,配制上述溶液肯定不需要的是______(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是______.
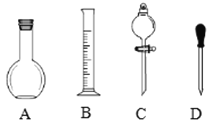
(2)在容量瓶的使用方法中,下列操作不正确的是______
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线. |
E.盖好瓶塞,用食指顶住瓶塞,另一只手的手指托住瓶底,把容量瓶反复倒转多次,摇匀.
(3)根据计算用托盘天平称取NaOH固体的质量为______g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”“小于”或“等于”).
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好.