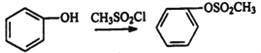题目内容
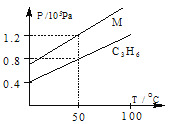
【题目】某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,测量剩余固体的质量随时间的变化关系,如图所示。
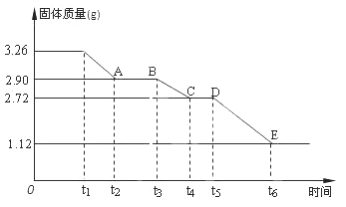
(1)t5~ t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色的气体物质的量是_______________________;
(2)x∶y=________________。
【答案】 0.0200mol 2∶3
【解析】(1)t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色,说明生成二氧化硫气体,根据元素得失电子知,还有氧气生成,1.12g可能为氧化钙的质量,物质的量为: ![]() =0.02mol,和0.02molCaSO4分解生成0.02mol氧化钙正好吻合,所以该反应方程式为:2CaSO4
=0.02mol,和0.02molCaSO4分解生成0.02mol氧化钙正好吻合,所以该反应方程式为:2CaSO4![]() 2CaO+2SO2↑+O2↑,因此生成的二氧化硫为0.02mol,故答案为:0.02mol;
2CaO+2SO2↑+O2↑,因此生成的二氧化硫为0.02mol,故答案为:0.02mol;
(2)从D点开始,t5~t6时间段固体质量减轻的原因是产生了两种气体,说明该点的固体为硫酸钙,则硫酸钙的物质的量=![]() =0.02mol,水的物质的量=
=0.02mol,水的物质的量=![]() =0.03mol,则x∶y=硫酸钙和水的物质的量之比=0.02mol:0.03mol=2:3,故答案为:2:3。
=0.03mol,则x∶y=硫酸钙和水的物质的量之比=0.02mol:0.03mol=2:3,故答案为:2:3。

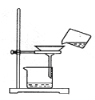
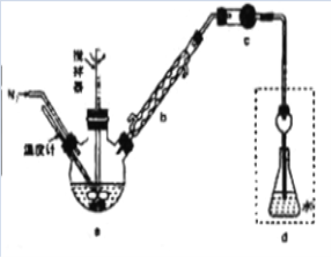
【题目】某实验兴趣小组将无水FeCl3与氯苯混合发生反应制备常用还原剂FeCl2,反应原理是:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑。按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3和225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。将生成的HCl用水吸收,利用莫尔法可以测出无水FeCl3的转化率(莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法)。
2FeCl2+C6H4Cl2+HCl↑。按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3和225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。将生成的HCl用水吸收,利用莫尔法可以测出无水FeCl3的转化率(莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法)。
已知有关数据如下:
C6H5Cl | C6H4Cl2 | |
熔点/℃ | -45 | 53 |
沸点/℃ | 132 | 173 |
回答下列问题:
(1)仪器b的作用是_______。干燥管c中盛装的试剂是________。
(2)反应结束后需向反应器a中吹入干燥的氮气,其目的是_________。
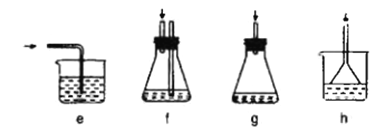
(3)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是_____(填序号)。
(4)从滤液中回收过量氯苯的操作是___________。
(5)将锥形瓶内溶液的pH调至6.0再加水稀释至1000mL,从中取10.0mL滴加几滴指示剂,用 0.2000mol/LAgNO3溶液进行滴定,当达到终点时,消耗22.50mLAgNO3溶液。
AgCl | AgBr | AgI | Ag2CrO4 | |
Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
颜色 | 白 | 淡黄 | 黄 | 砖红 |
①参照上表已知信息用硝酸银标准溶液滴定氯离子含量时可以作指示剂的是___(填字母)。
a.CaCl2 b.NaBr c.NaI d.K2CrO4
②滴定达终点的现象是_______
③无水FeC13的转化率a=_______%