题目内容
6.利用如图所示装置进行实验,下列说法不正确的是( )| A. |  如图实验可制取少量氨气 | |
| B. |  如图实验中逐滴滴加稀盐酸时,试管中开始无气泡 | |
| C. |  如图实验中酸性KMnO4溶液中有大量气泡出现,酸性KMnO4溶液褪色 | |
| D. |  如图实验可观察到红色喷泉 |
分析 A.碳酸氢铵加热分解生成氨气、水、二氧化碳,碱石灰可吸收水、二氧化碳;
B.碳酸钠先与HCl反应生成碳酸氢钠;
C.浓硫酸使蔗糖炭化后,C与浓硫酸反应生成二氧化碳、二氧化硫,二氧化硫与高锰酸钾发生氧化还原反应;
D.酚酞遇酸为无色.
解答 解:A.碳酸氢铵加热分解生成氨气、水、二氧化碳,碱石灰可吸收水、二氧化碳,则图装置可制备少量氨气,故A正确;
B.碳酸钠先与HCl反应生成碳酸氢钠,则逐滴滴加稀盐酸时,试管中开始无气泡,故B正确;
C.浓硫酸使蔗糖炭化后,C与浓硫酸反应生成二氧化碳、二氧化硫,二氧化硫与高锰酸钾发生氧化还原反应,则酸性KMnO4溶液中有大量气泡出现,酸性KMnO4溶液褪色,故C正确;
D.酚酞遇酸为无色,则观察到无色喷泉,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应与现象、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
相关题目
16.除去下列括号内杂质的试剂或方法错误的是( )
| A. | K2CO3(NH4Cl):加热 | |
| B. | CO2(SO2):饱和碳酸钠溶液、浓硫酸,洗气 | |
| C. | KCl溶液(BaCl2):加入适量K2SO4溶液,过滤. | |
| D. | 蛋白质(葡萄糖):浓Na2SO4溶液,盐析、过滤、洗涤 |
17.以乙烯为原料生产环氧乙烷,经典的方法是氯代乙醇法,包括以下两步反应:
①CH2=CH2+CI2+H2O→CICH2CH2OH+HCI
②
总的反应可表示为:
现代石油化式采用银作催化剂,可一步完成例:

经典的生产工艺的原子利用率是( )
①CH2=CH2+CI2+H2O→CICH2CH2OH+HCI
②

总的反应可表示为:

现代石油化式采用银作催化剂,可一步完成例:

经典的生产工艺的原子利用率是( )
| A. | 12.7% | B. | 25.4% | C. | 50.8% | D. | 76.2% |
1. 按如图装置进行实验,下列现象及推断正确的是( )
按如图装置进行实验,下列现象及推断正确的是( )
 按如图装置进行实验,下列现象及推断正确的是( )
按如图装置进行实验,下列现象及推断正确的是( )| 选项 | I中试剂 | Ⅱ中试剂及现象 | 推断 |
| A | 氯化铵 | 酚酞溶液变红 | 氯化铵容易分解 |
| B | 亚硫酸氢钠 | 溴水褪色 | SO2气体具有漂白性 |
| C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾褪色 | 石蜡油发生了化学变化 |
| D | 高锰酸钾 | 肥皂水冒泡 | 反应生成了氧气 |
| A. | A | B. | B | C. | C | D. | D |
11.用下列实验装置进行相应的实验,能达到实验目的是( )
| A. |  实验室制取Cl2 | B. |  检查碱式滴定管是否漏液 检查碱式滴定管是否漏液 | ||
| C. |  从食盐水中提取NaCl | D. |  制备收集干燥的NH3 |
18.部分弱酸的电离平衡常数如表:
下列选项正确的是( )
| 弱酸 | HCOOH | HCN | H2CO3 | HNO2 |
| 电离平衡常数(25℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=4.0×10-4 |
| A. | 甲酸和碳酸的分子式中均含两个氢原子,均属于二元酸 | |
| B. | 向NaCN溶液中通入少量的CO2:2CN-+H2O+CO2═2HCN+CO32- | |
| C. | 中和等体积、等pH的HCOOH和HNO2消耗NaOH的量前者大于后者 | |
| D. | 等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者 |
15.下列有关物质性质和应用的说法均正确的是( )
| A. | 常温下浓硫酸与铝不反应,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 常温下二氧化硅不与任何酸反应,可用石英容器盛放氢氟酸 | |
| C. | 铝热反应原理是炼铁最常用的反应原理 | |
| D. | 氧化铝熔点很高,可用作制造高温耐火材料,如制耐火砖、坩埚等 |
1.新华社北京5月18日电,中共中央、国务院祝贺我国海域可燃冰试采成功.“可燃冰”又称“天然气水合物”,它是在海底的高压、低温条件下形成的,外观像冰.下面关于“可燃冰”的叙述不正确的是( )
| A. | “可燃冰”有可能成为人类未来的重要能源 | |
| B. | “可燃冰”是一种比较洁净的能源 | |
| C. | “可燃冰”提供了水可能变成油的例证 | |
| D. | “可燃冰”的主要可燃成分是甲烷 |
 ).
).

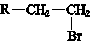
 (R-代表烃基)
(R-代表烃基)