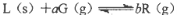题目内容
在一固定容积的密闭容器中进行如下反应:
 其平衡常数K和温度,的关系如下:
其平衡常数K和温度,的关系如下:

(1)该反应的平衡常数K的表达式为___________________。
(2)该反应的正反应为__________(填“吸热”“放热”)反应。
(3)能判断该反应是否已经达到化学平衡状态的是___________。
A.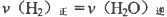 B.混合气体中CO浓度不变
B.混合气体中CO浓度不变
(4)在850℃时,可逆反应:
在该容器内各物质的浓度变化如下:
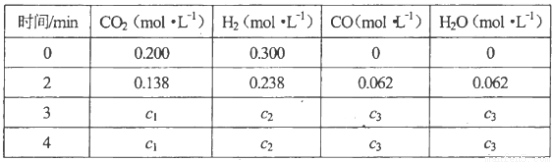
计算:3min~4min达到平衡时,CO的平衡浓度c3=________,CO2(g)的转化率a=________。
(共10分)(1)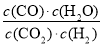 (2分)
(2分)
(2)放热(2分)
(3)AB(2分)
(4)0.120mol/L (2分) 60%(2分)
【解析】
试题分析:(1)根据平衡常数的定义得该反应的平衡常数K的表达式为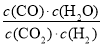
(2)随温度升高,K逐渐减小,说明升温平衡逆向移动,所以正向为放热反应;
(3)A、达到化学平衡状态时,v正= v逆,且H2与H2O的物质的量之比为1:1,正确;B、达到化学平衡状态时,各物质的浓度不变,正确,答案选AB。
(4)850°C时,K=1.0,所以c3×c3=(0.2- c3)×(0.3- c3),解得c3=0.12mol/L,CO2的转化率为0.12 mol/L÷0.2 mol/L×100%=60%
考点:考查化学平衡常数的定义、化学平衡的移动、化学平衡状态的判断、化学平衡的计算

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目