题目内容
1.常温下,下列反应的离子方程式与向Ba(OH)2溶液中逐滴加入稀硫酸反应的离子方程式相同的是( )| A. | 向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至Ba2+恰好完全沉淀 | |
| B. | 向NaHSO4溶液中.逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀 | |
| C. | 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量 | |
| D. | 向pH=1的NaHSO4溶液中加入等体积pH=13的Ba(OH)2溶液 |
分析 Ba(OH)2溶液中逐滴加入稀硫酸,反应生成硫酸钡沉淀和水,反应的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,
A.钡离子恰好沉淀,氢氧化钡与硫酸氢钠按照物质的量1:1反应生成硫酸钡、强氧化钠和水;
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀,反应生成硫酸钡、氢氧化钠和水;
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量,反应生成硫酸钡、氢氧化钠和水;
D.两溶液恰好反应生成硫酸钡沉淀和水,溶液为中性.
解答 解:向Ba(OH)2溶液中逐滴加入稀硫酸,离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,
(2)A.向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至Ba2+恰好完全沉淀,氢氧化钡与硫酸氢钠按照物质的量1:1反应生成硫酸钡、强氧化钠和水,反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O,不符合要求,故A错误;
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀,反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O,不符合要求,故B错误;
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量,离子方程式按照硫酸氢钠的化学式书写,反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O,不符合要求,故C错误;
D.pH=1的NaHSO4溶液中氢离子浓度为0.1mol/L,pH=13的Ba(OH)2溶液中氢氧根离子浓度为0.1mol/L,两溶液等体积混合,反应后溶液为中性,反应的离子方程式为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,符合条件,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高考常见的题型,题目难度中等,注意掌握离子方程式的书写原则,把握反应的实质为解答关键,试题有利于培养学生灵活应用所学知识的能力.

 考前必练系列答案
考前必练系列答案| A. | 1,2-二甲基戊烷 | B. | 2-乙基-3-戊烯 | ||
| C. | 3,4-二甲基-4-丁醇 | D. | 3-甲基-2-戊醇 |
| A. | SO2 | B. | CO | C. | HCHO | D. | NO |
| A. | 淀粉和纤维素 | B. | 甲烷和乙烷 | C. | 12C和14C | D. | 蔗糖和麦芽糖 |
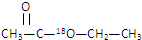 与足量的稀硫酸混合加热使其水解,在所得乙醇分子中的氧原子含有的中子为( )
与足量的稀硫酸混合加热使其水解,在所得乙醇分子中的氧原子含有的中子为( )| A. | 8mol | B. | 小于8mol | C. | 等于10mol | D. | 小于10mol |
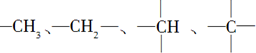 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示.例如:
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示.例如: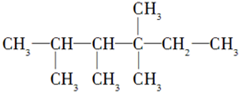
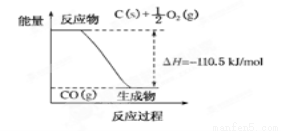
 ;E3+的离子符号为Fe3+.
;E3+的离子符号为Fe3+.