题目内容
4.下列实验式中,没有相对分子质量也可以确定分子式的是( )①CH3 ②C2H5 ③C2H6O ④CH2.
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ②③ |
分析 因为碳氢化合物或含氧衍生物中碳成4条键,所以氢原子数必定是偶数,而且根据烷烃通式可得,最多氢原子数=2n+2(n是碳原子数),氧原子不影响氢原子数目,据此分析.
解答 解:①因为如果只有一个碳,必需CH4,如果3个碳就是C3H9,但最多只可能是C3H8,所以分子式一定是C2H6,故正确;
②最简式为C2H5,氢原子为偶数,若氢原子为10,分子式为C4H10,已达饱和结构,所以分子式一定是C4H10,故正确;
③C2H6O中已达饱和结构,为乙醇或二甲醚,故正确;
④任何烯烃最简式都是CH2,故错误.
故选B.
点评 本题考查了根据实验式确定分子式,中等难度,碳成4条键,氢原子数必定是偶数,氢原子数最多为2n+2(n是碳原子数)是判断依据.

练习册系列答案
相关题目
9.除去Cu粉中的Al粉不能用( )
| A. | 加入稀H2SO4,过滤 | B. | 加入NaCl溶液,过滤 | ||
| C. | 加入NaOH溶液,过滤 | D. | 加入CuSO4溶液,过滤 |
15.Ⅰ.碱性锌锰干电池是最常见的化学电源之一,已知其电池总反应:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极发生反应的物质为Zn+2OHˉ-2eˉ=Zn(OH)2;发生在正极的电极反应为MnO2+H2O+e-=MnO(OH)+OH-.
Ⅱ.回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、MnOOH、Fe和炭黑等),由锰粉制取MnO2的步骤如图所示:
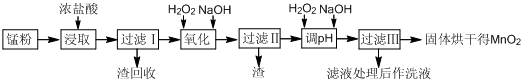
根据如图所示步骤并参考表格数据回答问题:
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等.加热的作用是加快反应速率.
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入适量H2O2溶液,其作用是将Fe2+转化为Fe3+.
(3)将过滤I所得滤液经H2O2氧化后,再加入NaOH溶液调节pH的范围是:3.7<pH<8.3,其目的是使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀.
(4)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O.
(5)实验室进行过滤操作时,需要用到的玻璃仪器有漏斗、烧杯、玻璃棒.
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极发生反应的物质为Zn+2OHˉ-2eˉ=Zn(OH)2;发生在正极的电极反应为MnO2+H2O+e-=MnO(OH)+OH-.
Ⅱ.回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、MnOOH、Fe和炭黑等),由锰粉制取MnO2的步骤如图所示:

| 开始沉淀 | 沉淀完全 | |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等.加热的作用是加快反应速率.
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入适量H2O2溶液,其作用是将Fe2+转化为Fe3+.
(3)将过滤I所得滤液经H2O2氧化后,再加入NaOH溶液调节pH的范围是:3.7<pH<8.3,其目的是使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀.
(4)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O.
(5)实验室进行过滤操作时,需要用到的玻璃仪器有漏斗、烧杯、玻璃棒.
12.可逆反应mA(g)+nB(g)?pC(g)+qD(g)的v-t图象如图,若其它条件不变,只是在反应前加入合适的催化剂,其v-t图象如图:则①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中不正确的是( 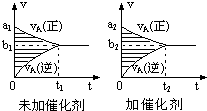 )
)
 )
)| A. | ②④⑤⑦ | B. | ①④⑥⑧ | C. | ②③⑤⑧ | D. | ①③⑥⑧ |
19.CoCl2•xH2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种新工艺流程如图:
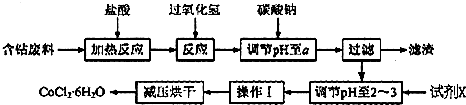
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl═CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)写出加入过氧化氢时溶液中发生的离子反应方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
(2)加入碳酸钠调节pH至a,a的范围是5.2~7.6;
(3)最合适的试剂X是盐酸
(4)操作I包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和减压过滤.
(5)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl═CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Co(OH)3 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.2 | 5.2 |
(1)写出加入过氧化氢时溶液中发生的离子反应方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
(2)加入碳酸钠调节pH至a,a的范围是5.2~7.6;
(3)最合适的试剂X是盐酸
(4)操作I包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和减压过滤.
(5)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
9.如图为三种有机物是某些药物中的有效成分:
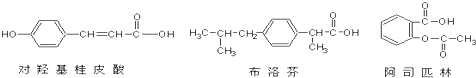
以下说法不正确的是( )

以下说法不正确的是( )
| A. | 三种有机物都属于芳香化合物 | |
| B. | 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 | |
| C. | 将各1mol的三种物质分别与氢氧化钠溶液充分反应,阿司匹林消耗氢氧化钠最多 | |
| D. | 三种有机物都能与浓溴水发生反应 |
16.标准状况下质量为4g H2的体积约为( )
| A. | 11.2 L | B. | 22.4 L | C. | 33.6 L | D. | 44.8 L |
13.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 钠与水的反应:2Na+2H2O═2Na++OH-+H2↑ | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
14.下列说法不正确的是( )
| A. | 分散质粒子的直径在10-9~10-7m之间的分散系叫做胶体 | |
| B. | KAl(SO4)2在水溶液中电离方程式为KAl(SO4)2═K++Al3++2SO42- | |
| C. | 利用丁达尔效应可以鉴别CuSO4溶液和氢氧化铁胶体 | |
| D. | 在FeCl3溶液中滴加NaOH溶液可得氢氧化铁胶体 |