题目内容
【题目】某同学依照如下图所示流程提取海带中的碘元素。
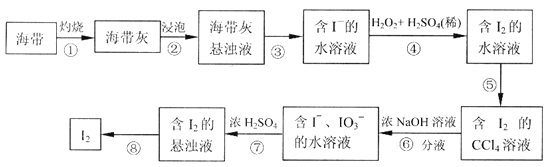
(1)步骤①中灼烧海带所用的仪器是__________(填序号)。
a. 试管 b. 坩埚 c. 烧杯
(2)步骤④中用硫酸酸化的H2O2溶液将I-氧化成I2,反应的离子方程式是
______________________________________________________________。
(3)步骤⑤中采用的分离方法是______________________________。
(4)步骤⑤还可以选用的试剂是_______________(填字母序号)。
a. 苯 b. 乙醇 c. 乙酸 d. 己烷
(5)经步骤⑤得到含I2的CCl4溶液后,继续采取步骤⑥⑦的目的是____________________。
(6)步骤⑦的反应中,当1mol IO3- 发生反应时,转移电子的物质的量是__________mol。
【答案】 b 2I- +H2O2+2H+=I2+2H2O 萃取、分液 ad 从I2的CCl4溶液中分离出I2 5
【解析】(1)固体灼烧需要在坩埚中进行,所以步骤①中灼烧海带用到的实验仪器是坩埚,答案选b。(2)步骤④中用硫酸酸化的H2O2溶液将I-氧化成I2,反应的离子方程式是2I- +H2O2+2H+=I2+2H2O;(3)步骤⑤中采用的分离方法是萃取、分液;(4)步骤⑤是萃取,萃取适合于溶质在不同溶剂中的溶解性不同而分离的一种方法,选用的萃取剂的原则是:①和原溶液中的溶剂互不相溶更不能发生化学反应;②溶质在该溶剂中溶解度要远大于原溶剂。乙酸和乙醇都是与水互溶的,所以可以选择的有机溶剂是苯和己烷,答案选ad;(5)由流程图可知,经步骤⑤得到含I2的CCl4溶液后,继续采取步骤⑥⑦的目的是从I2的CCl4溶液中分离出I2;(6) 步骤⑦的反应的化学方程式为IO3—+ 5I-+6H+ +3I2+3H2O,由反应方程式可得关系式为IO3—~5e-,故当1mol发生反应时,转移电子的物质的量是5mol。