题目内容
【题目】某热再生电池工作原理如图所示。放电后,可利用废热进行充电。已知电池总反应:Cu2++4NH3![]() [Cu(NH3)4]2+ ΔH<0。下列说法正确的是( )
[Cu(NH3)4]2+ ΔH<0。下列说法正确的是( )
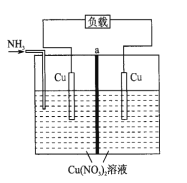
A.充电时,能量转化形式主要为电能到化学能
B.放电时,负极反应为NH3-8e-+9OH-=NO3-+6H2O
C.a为阳离子交换膜
D.放电时,左池Cu电极减少6.4g时,右池溶液质量减少18.8g
【答案】D
【解析】
已知电池总反应:Cu2++4NH3 [Cu(NH3)4]2+ △H<0,放出的热量进行充电,通入氨气的电极为原电池负极,电极反应Cu2e=Cu2+,通入氨气发生反应Cu2++4NH3[Cu(NH3)4]2+ △H<0,右端为原电池正极,电极反应Cu2++2e=Cu,中间为阴离子交换膜,据此分析。
已知电池总反应:Cu2++4NH3 [Cu(NH3)4]2+ △H<0,放出的热量进行充电,通入氨气的电极为原电池负极,电极反应Cu2e=Cu2+,通入氨气发生反应Cu2++4NH3[Cu(NH3)4]2+ △H<0,右端为原电池正极,电极反应Cu2++2e=Cu,中间为阴离子交换膜;
A.充电时,能量转化形式主要为热能→化学能,故A错误;
B.放电时,负极反应为Cu+4NH32e=[Cu(NH3)4]2+,故B错误;
C.原电池溶液中阴离子移向负极,a为阴离子交换膜,故C错误;
D.放电时,左池Cu电极减少6.4 g时,Cu2e=Cu2+,电子转移0.2mol,右池溶液中铜离子析出0.1mol,硝酸根离子移向左电极0.2mol,质量减少=0.2mol×62g/mol+0.1mol×64g/mol=18.8 g,故D正确;
故答案选D。

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目