题目内容
【题目】下列关于电解质溶液的判断正确的是
A. 100℃时,NaCl溶液的pH<7,则溶液呈酸性
B. 将pH=4的 CH3COOH溶液加水稀释,溶液中所有离子的浓度均减小
C. 常温下,CH3COOH分子可能存在于pH>7的碱性溶液中
D. 向氨水中加入盐酸至中性,溶液中![]() 一定增大
一定增大
【答案】C
【解析】
A.100℃时,水的电离程度增大,溶液中氢离子的浓度增大,所以该温度下氯化钠溶液的pH<7,因为氯化钠溶液中c(H+)=c(OH-),所以氯化钠溶液为中性溶液,故A错误;
B.pH=4的CH3COOH溶液加水稀释,因为水的离子积不变,所以稀释过程中氢离子浓度减小,则氢氧根离子浓度增大,故B错误;
C.常温下,CH3COOH分子可能存在于pH>7的碱性溶液中,如醋酸钠溶液中醋酸根离子水解成醋酸和氢氧根离子,即醋酸钠溶液中存在醋酸分子,故C正确;
D.氨水中加入盐酸,若恰好完全反应,溶液呈酸性,要使溶液呈中性,则氨水过量,所以溶质为氯化铵和一水合氨,但![]() 为一水合氨的电离平衡常数,温度不变,是一定值,故D错误。
为一水合氨的电离平衡常数,温度不变,是一定值,故D错误。
故选C。

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】下列实验操作不能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 比较金属镁和铝的活泼性 | 分別向两只盛有等体积等浓度的稀硫酸烧杯中加入打磨过的同样大小的镁片和铝片,比较反应现象 |
B | 除去Mg粉中混有的Al 粉 | 加入足量的NaOH 溶液,过滤、洗涤、干燥 |
C | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
D | 配制0.4000mol·L1的NaOH溶液 | 称取4.0g固体NaOH于烧杯中,直接向烧杯中加入250mL水 |
A. AB. BC. CD. D
【题目】泄盐(MgSO4·7H2O)是一种中药药剂,还可用于制革、肥料、瓷器、印染料等工业。一种利用氯碱工业的废渣(主要成分是Mg(OH)2,杂质为MnCO3、FeCO3、Al(OH)3、SiO2等)生产泄盐的流程如下:
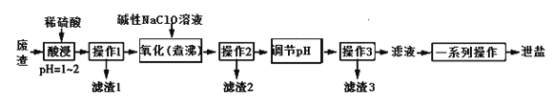
已知部分氢氧化物沉淀pH如下表:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Al(OH)3 | Al(OH)3在pH=7.8时开始溶解,pH=10.0完全溶解 |
开始沉淀的pH | 2.3 | 10.8 | 3.7 | |
完全沉淀的pH | 4.3 | 12.4 | 5.2 |
回答下列问题:
(1) “酸浸”是工业对矿物利用的一种方法,该操作关键是提供浸取率和浸取速率,写出提高该工艺流程中“酸浸”速率的2种方法:___________________。
(2) “操作1” “操作2”和“操作3”相同,实验室在进行该操作时,用到的玻璃仪器有________,“滤渣1”的成分是________(写化学式)。
(3) “氧化(煮沸)”操作的目的是使溶液中的锰元素转化为MnO2,写出该反应的离子方程式:____________________。
(4)“调节pH”时最好选用__________, pH范围应控制为____________,高温加热“滤渣3”可得到_________(写化学式)。
(5) “一系列操作”是指_____________________________。




