题目内容
2SO2(g)+O2(g)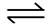 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
请回答下列问题:
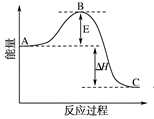
图中A、C分别表示________________、________________,
E的大小对该反应的反应热有无影响?______________。
(2)图中ΔH=____________ kJ·mol-1;
(3) 反应速率v(SO2)为0.05 mol · L-1 · min-1,则v(O2)=____________mol · L-1 · min-1、
v(SO3)=____________mol · L-1 · min-1;
(4) 已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH=________。
 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
请回答下列问题:
图中A、C分别表示________________、________________,
E的大小对该反应的反应热有无影响?______________。
(2)图中ΔH=____________ kJ·mol-1;
(3) 反应速率v(SO2)为0.05 mol · L-1 · min-1,则v(O2)=____________mol · L-1 · min-1、
v(SO3)=____________mol · L-1 · min-1;
(4) 已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH=________。
(1)反应物能量 生成物能量 没有影响 (2)-198 (3) 0.025 0.05
(4)-1185kJ·mol-1
(4)-1185kJ·mol-1
试题分析:(1)有图可以知道,A为反应物能量,B为生成中间物的能量,C为生成物能量,且E的大小对该反应的反应热没有影响,但是对反应速率有影响,(2)中,1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1,所以2SO2(g)+O2(g)
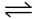 2SO3(g)的
2SO3(g)的ΔH=-198 _mol · L-1 · min-1;(3)v(SO2)为0.05 mol · L-1 · min-1,v(O2)=0.05/mol · L-1 · min-12="0.025mol" · L-1 · min-1、v(SO3)= v(SO2)="0.05" mol · L-1 · min-1,(4)又S(s)生成 SO3(g),要经过两部,一步是S(s)生成SO2(g),一步是SO2(g)氧化为1 mol SO3(g),
即S(s)+O2(g)
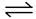 SO2(g) ΔH1="-296" kJ·mol-1,
SO2(g) ΔH1="-296" kJ·mol-1,2SO2(g)+O2(g)
 2SO3(g)ΔH2=-99 kJ·mol-1,即由S(s)生成3 mol SO3(g)的
2SO3(g)ΔH2=-99 kJ·mol-1,即由S(s)生成3 mol SO3(g)的ΔH=ΔH1×3+1.5ΔH2=(-296×3+1.5×-99 )kJ·mol-1=-1185kJ·mol-1。
点评:本题考查了化学反应速率以及盖斯定律,前面的题目比较容易,最后一个空有一定的难度,特别是很多学生认为硫可以一步转化为三氧化硫。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
 2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是 ( )
2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是 ( ) 2C(g)+2D(g),下列四个数据是在不同条件下测出的该反应的速率,其中最快( )
2C(g)+2D(g),下列四个数据是在不同条件下测出的该反应的速率,其中最快( )