题目内容
【题目】亚氯酸钠(NaClO2)是重要漂白剂。探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按图下装置进行制取。
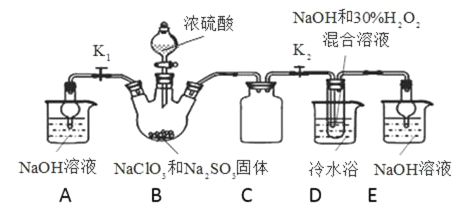
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,38-60℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是__________________________________。
(2)B中产生的ClO2是__________(填“氧化产物”或“还原产物”)。
(3)装置D中反应生成NaClO2的化学方程式为____________________________。反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH—外还可能含有SO42-,检验SO42-离子的方法是________________。
实验Ⅱ:样品杂质分析与纯度测定
(4)测定样品中NaClO2的纯度。测定时进行如下实验:准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①确认滴定终点的现象是__________________________________________________。
②所称取的样品中NaClO2的物质的量为______________(用含c、V的代数式表示)。
【答案】防止D瓶溶液倒吸到B瓶中(或答防止倒吸或安全瓶的作用) 还原产物2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-当滴入最后一滴Na2S2O3标准液溶液蓝色褪去,且半分钟内不恢复原色cV10-3mol
【解析】
(1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;综上所述,本题答案是:防止D瓶溶液倒吸到B瓶中(或答防止倒吸或安全瓶的作用) 。
(2)装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成ClO2和Na2SO4,反应的方程式为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O,根据反应可知到ClO2为还原产物;综上所述,本题答案是:还原产物。
(3)装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可以知道,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,B制得的气体中含有SO2,在装置D中被氧化生成硫酸,溶液中可能存在SO42-,用氯化钡溶液检验SO42-,具体操作:取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-;因此,本题正确答案是:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 ;取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42- 。
(4)①碘与淀粉变蓝,由于发生I2 +2S2O32-=2I-+S4O62-反应,碘不断地被消耗,当滴入最后一滴Na2S2O3标准液溶液蓝色褪去,且半分钟内不恢复原色,反应达到滴定终点;综上所述,本题答案是:当滴入最后一滴Na2S2O3标准液溶液蓝色褪去,且半分钟内不恢复原色。
②令样品中NaClO2的物质的量x,则:
NaClO2~2I2~4S2O32-,
1mol 4mol
0.25x cmolL-1×V×10-3L
故x=cV10-3mol;因此,本题正确答案是:cV10-3mol。