题目内容
12.下列物质属于碱性氧化物的是( )| A. | SO3 | B. | CaO | C. | SO2 | D. | CO |
分析 碱性氧化物是指能跟酸起反应,生成盐和水的氧化物.一般来说金属氧化物大部分是碱性氧化物,而且碱性氧化物一定是金属氧化物.
解答 解:碱性氧化物是指能和酸反应生成盐和水的氧化物,CaO是碱性氧化物,它能和酸反应生成盐和水,且为氧化物;而SO3、SO2和碱反应生成盐、水,属于酸性氧化物,不是碱性氧化物;CO不和酸碱反应,属于不成盐氧化物.
故选B.
点评 本题考查了碱性氧化物的概念,碱是指能与酸起反应生成盐和水的氧化物,大多数金属氧化物是碱性氧化物,可以说碱性氧化物一定是金属氧化物,但不能说金属氧化物一定是碱性氧化物,题目难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
3.将4gNaOH溶解在10ml水中,再稀释成1L的溶液,从中取出10ml,这10ml溶液的物质的量浓度是( )
| A. | 1 mol/L | B. | 0.1mol/L | C. | 0.001mol/L | D. | 10mol/L |
20.下列有关化学用语的表示正确的是( )
| A. | NH4Cl的电子式: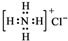 | |
| B. | Cl-的结构示意图: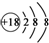 | |
| C. | 二氧化碳的电子式:${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$C${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ | |
| D. | 中子数为16的硫离子:${\;}_{16}^{32}$S2- |
7.设NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol | |
| B. | 6.4gS6与S8的混合物中所含S原子数一定为0.4NA | |
| C. | 标准状况下,22.4L苯中含NA个分子 | |
| D. | 1molH2SO4中所含的粒子数目一定是NA |
17.下列说法正确的是(NA表示阿伏加德罗常数)( )
| A. | 15g 甲基中含有的电子数为10NA | |
| B. | 标准状况下,以任意比例混合的甲烷和丙烷混合物22.4L,所含有的分子数为NA | |
| C. | 标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA | |
| D. | 在1L 1mol/L 的盐酸溶液中,所含氯化氢分子数为NA |
4.下列离子方程式表达正确的是( )
| A. | 用稀硝酸洗涤做银镜反应的试管:3Ag+4H++NO3-=3Ag++NO↑+2H2O | |
| B. | 用氢氧化钠溶液除去铝表面的氧化膜:Al(OH)3+OH-=AlO2-+2H2O | |
| C. | 用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+=Cu2++2H2O | |
| D. | 用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
1.少量铁粉与100mL 0.01mol•L-1的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦把反应器敞开放入100℃水浴中 ⑧改用10mL 0.1mol/L盐酸( )
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦把反应器敞开放入100℃水浴中 ⑧改用10mL 0.1mol/L盐酸( )
| A. | ①⑥⑦ | B. | ③⑧ | C. | ③⑦⑧ | D. | ⑦⑧ |
2.下列有关分类和氧化还原的描述正确的是( )
| A. | 酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系 | |
| B. | 纯碱、烧碱、熟石灰均属于碱,酸、碱、盐之间发生的反应均属于复分解反应 | |
| C. | 得电子越多的氧化剂,其氧化性就越强;含最高价元素的化合物一定具有强的氧化性 | |
| D. | 元素的单质可由氧化或还原含该元素的化合物来制得 |