题目内容
已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在。以Al—H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法不正确的是 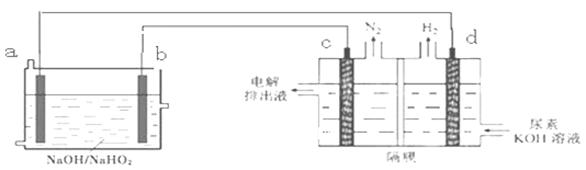
| A.燃料电池的总反应为:2Al+3HO2-= 2AlO2- + OH- +H2O |
| B.电极b是正极,且反应后该电极区pH增大 |
| C.电解过程中,电子的流向由a→b→c→d. |
| D.电解时,Al消耗2.7g,则产生氮气标准状况下为1.12L |
D
解析试题分析:A、Al—H2O2燃料电池Al为负极,总反应为Al+3H2O2+OH-=AlO2-+HO2-+3H2O,错误;B、根据电解池中d极产生H2应为H+放电,故d为阴极,所以a是负极,b为正极,正极区电极反应为H2O2结合OH-生成HO2-,所以pH减小,B错误;C、根据上面分析,a为负极故电子流向为a→d,c→b,错误;D、由CO(NH2)2→N2,每生成1molN2,转移6mol电子,需要消耗2molAl,故消耗2.7gAl(0.1mol)转移0.3mol电子,可生成0.05molN2,标准状况下体积为1.12L,正确。
考点:考查原电池原理及电解原理等知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH-下列叙述不正确的是( )
| A.H2通入负极区 | B.O2通入正极区 |
| C.负极发生氧化反应 | D.正极发生氧化反应 |
用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )
| A.1 mol·L-1 | B.2 mol·L-1 | C.3 mol·L-1 | D.4 mol·L-1 |
下图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池)。下列有关说法不正确的是
| A.放电时正极反应为:NiOOH+H2O+e-→Ni(OH)2+OH- |
| B.电池的电解液可为KOH溶液 |
| C.充电时负极反应为:MH+OH-→+H2O+M+e- |
| D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如图所示。下列说法正确的是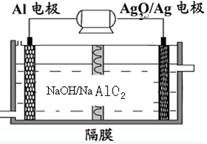
| A.电池负极反应式2Ag+2OH--2e-=" Ag" 2O+H2O |
| B.放电时电池负极附近PH减小 |
| C.电池总反应式2Al+3Ag2O+6H+ =2Al3++6Ag+3H2O |
| D.电解液中Na+通过隔膜由右向左移动 |
下图是模拟电化学反应装置图。下列说法中错误的是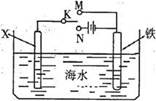
| A.若X为碳棒,开关K置于N处,可以减缓铁的腐蚀 |
| B.若X为锌,开关K置于N处,则X极附近溶液的颜色会变黄色 |
| C.若X为碳棒,开关K置于M处,则X电极的电极反应式为:O2+4e-+2H2O=4OH- |
| D.若X为锌,开关K置于M处,保护铁电极,则为牺牲阳极的阴极保护法 |
下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是( )
| A.在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多 |
| B.同价态的阳离子,甲比乙的氧化性强 |
| C.甲能跟稀盐酸反应放出氢气而乙不能 |
| D.将甲、乙作电极组成原电池时,甲是正极 |
下列各组材料中,不能组成原电池的是 ( )
| | A | B | C | D |
| 两极材料 | Zn片、石墨 | Cu片、Ag片 | Zn片、Cu片 | Fe片、Cu片 |
| 插入溶液 | 硫酸溶液 | 硝酸银溶液 | 蔗糖溶液 | 稀盐酸 |
