题目内容
【题目】用 NA 表示阿伏加德罗常数的值,下列说法正确的是()
A.电解精炼铜,当外电路通过 NA 个电子时,阳极质量减小 32 g
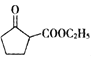
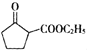
B.反应 3H2(g)+N2(g)![]() 2NH3(g)ΔH=-92 kJ·mol-1,当放出 9.2 kJ 热量时,反应的 N2 为2.24L
2NH3(g)ΔH=-92 kJ·mol-1,当放出 9.2 kJ 热量时,反应的 N2 为2.24L
C.常温常压下 27 克 Al 与 33.6L 氯气完全反应,电子转移数小于 3NA
D.1 mol·L-1 氯化铜溶液中,若 Cl-的数目为 2NA,则 Cu2+的数目略小于 NA
【答案】D
【解析】
A.电解精炼铜时,阳极上放电的除了铜,还有比铜活泼的金属杂质,故当转移NA个电子时,阳极减少的质量不等于32g,故A错误;
B.反应3H2(g)+N2(g)2NH3(g)ΔH=-92 kJ·mol-1,转移6mol电子,放出热量9.2kJ时,转移电子0.6NA,反应的N2标况下为2.24L,故B错误;
C.常温常压下与33.6L氯气的物质的量小于1.5mol, 所以与27克Al不能完全反应,故C错误;
D.氯化铜的化学式为CuCl2,n( Cu2+): n(Cl-)= 2:1,所以在1mol·L-1氯化铜溶液中,若Cl-的数目为2NA,则Cu2+水解少量消耗,数目略小于NA,故D正确;
故选D。

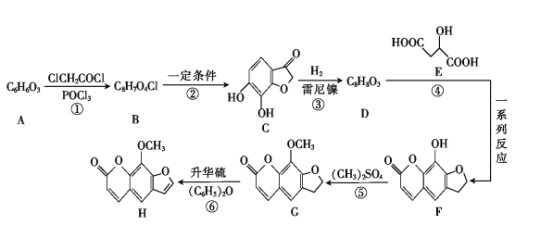
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如图:
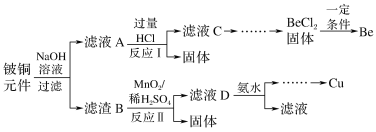
已知:Ⅰ.铍、铝元素的化学性质相似,单质铍与氢氧化钠溶液反应生成可溶于水的Na2BeO2
Ⅱ.常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的主要成分除NaOH外,还有__(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:__。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为__(填字母)。
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
②从BeCl2溶液中得到BeCl2固体的操作是__。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:__。
②若用浓HNO3溶解金属硫化物,缺点是__(任写一条)。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是__(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于__。
(5)电解NaCl-BeCl2混合熔盐可制备金属铍,如图是电解装置图。
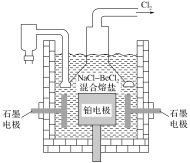
①石墨电极上的电极反应式为__。
②电解得到的Be蒸气中约含1%的Na蒸气除去Be中少量Na的方法为__。
已知部分物质的熔、沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |