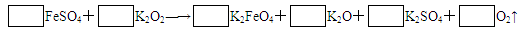题目内容
高铁酸钾K2FeO4是一种新型、高效、氧化性比Cl2更强的水处理剂,工业上通常用下列反应先制得高铁酸钠:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,然后在某低温下,在高铁酸钠溶液中加KOH固体至饱和就可析出高铁酸钾,下列有关说法不正确的是( )A.Na2O2在反应中既作氧化剂,又作还原剂
B.制取高铁酸钠时,每生成1molNa2FeO4反应中共有4mol电子转移
C.高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小
D.K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮杂质
【答案】分析:A.从化合价的角度分析;
B.根据Fe元素的化合价变化判断;
C.加入KOH固体,可析出高铁酸钾,从沉淀平衡的角度分析;
D.K2FeO4具有强氧化性,可杀菌消毒,Fe(OH)3胶体具有吸附性.
解答:解:A.Na2O2在反应中,没有全部生成O2,O元素的化合价分别变为-2价、0价,则Na2O2在反应中既作氧化剂,又作还原剂,故A正确;
B.反应中Fe的化合价有+3价升高为+6价,每生成lmolNa2FeO4反应中共有3mol电子转移,故B错误;
C.加入KOH固体,可析出高铁酸钾,说明高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小,故C正确;
D.K2FeO4具有强氧化性,可杀菌消毒,Fe(OH)3胶体具有吸附性,可用来净水,故D正确.
故选B.
点评:本题考查氧化还原反应,题目难度中等,易错点为A,注意元素化合价的变化以及反应物和生成物的物质的量的关系,为解答该题不可忽视的地方.
B.根据Fe元素的化合价变化判断;
C.加入KOH固体,可析出高铁酸钾,从沉淀平衡的角度分析;
D.K2FeO4具有强氧化性,可杀菌消毒,Fe(OH)3胶体具有吸附性.
解答:解:A.Na2O2在反应中,没有全部生成O2,O元素的化合价分别变为-2价、0价,则Na2O2在反应中既作氧化剂,又作还原剂,故A正确;
B.反应中Fe的化合价有+3价升高为+6价,每生成lmolNa2FeO4反应中共有3mol电子转移,故B错误;
C.加入KOH固体,可析出高铁酸钾,说明高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小,故C正确;
D.K2FeO4具有强氧化性,可杀菌消毒,Fe(OH)3胶体具有吸附性,可用来净水,故D正确.
故选B.
点评:本题考查氧化还原反应,题目难度中等,易错点为A,注意元素化合价的变化以及反应物和生成物的物质的量的关系,为解答该题不可忽视的地方.

练习册系列答案
相关题目