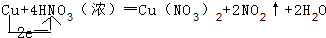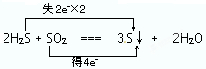题目内容
对于下列氧化还原反应,请按要求填空。
(1)Cu + 4HNO3(浓) === Cu(NO3)2 + 2NO2↑ + 2H2O
①氧化剂____________②离子方程式____________________________
(2)2H2S + SO2 === 3S↓ + 2H2O
①用双线桥法标出电子转移的方向和数目____________________________
②若氧化产物比还原产物多1.6g,则反应中电子转移的个数为________________
(1)①HNO3 ②Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
(2)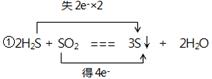 ②1.204×1023或0.2NA
②1.204×1023或0.2NA
【解析】
试题分析:(1)根据反应的化学方程式可知,铜元素的化合价从0价升高到+2价,失去2个电子,硝酸中氮元素的化合价从+5价降低到+4价,得到1个电子,所以氧化剂是硝酸,该反应的离子方程式是Cu+4H++2NO3-=Cu2++2NO2↑+2H2O。
(2)①该反应的化学方程式可知,H2S中S元素的化合价从-2价升高到0价,失去2个电子,做还原剂。SO2中S元素的化合价从+4价降低到0价,得到4个电子,做氧化剂,所以表示为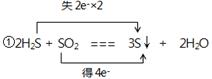 。
。
②根据2H2S + SO2
=== 3S↓ + 2H2O可知,每转移4个电子,氧化产物比还原产物多32g,所以若氧化产物比还原产物多1.6g,则反应中电子转移的物质的量为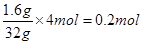 ,因此电子的个数是0.2NA。
,因此电子的个数是0.2NA。
考点:考查氧化还原反应的表示、有关判断和计算以及离子方程式的书写
点评:该题是中等难度的试题,试题注重基础,侧重能力的培养。该题的关键是准确标出有关元素的化合价变化情况,然后依据电子的得失守恒直接列式计算即可,有利于培养学生的逻辑思维能力和应试能力,以及规范的答题能力。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案