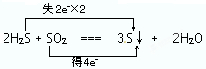题目内容
对于下列氧化还原反应,请按要求填空.
(1)Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
①用单线桥法标出电子转移的方向和数目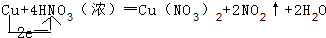
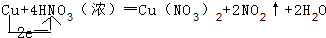
②氧化剂
③离子方程式:
(2)2H2S+SO2═3S↓+2H2O
①用双线桥法标出电子转移的方向和数目

②若氧化产物比还原产物多1.6g,则反应中电子转移的个数为
(1)Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
①用单线桥法标出电子转移的方向和数目
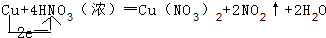
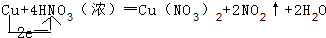
②氧化剂
硝酸
硝酸
氧化产物硝酸铜
硝酸铜
③离子方程式:
Cu+4H++2NO3-═Cu2++2NO2↑+2H2O
Cu+4H++2NO3-═Cu2++2NO2↑+2H2O
(2)2H2S+SO2═3S↓+2H2O
①用双线桥法标出电子转移的方向和数目


②若氧化产物比还原产物多1.6g,则反应中电子转移的个数为
1.204×1023
1.204×1023
.分析:(1)氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,根据元素化合价变化计算转移电子数;
(2)该反应中硫元素的化合价变化为+4价、-2价变为0价,该反应中氧化产物和还原产物都是硫单质,根据硫单质和转移电子之间的关系式进行计算.
(2)该反应中硫元素的化合价变化为+4价、-2价变为0价,该反应中氧化产物和还原产物都是硫单质,根据硫单质和转移电子之间的关系式进行计算.
解答:解:(1)①该反应中铜元素的化合价变化为0价→+2价,氮元素的化合价变化为+5价→+4价,所以得失电子的最小公倍数是2,所以其电子转移的方向和数目为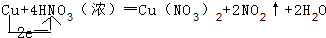 ,
,
故答案为: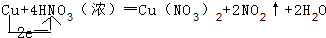 ;
;
②该反应中得电子化合价降低的是硝酸,失电子化合价升高的是铜,所以硝酸是氧化剂,硝酸铜是氧化产物,故答案为:HNO3;Cu(NO3)2;
③该反应的离子反应方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
(2)①该反应中,硫化氢中硫元素的化合价变化由-2价变为0价,二氧化硫中硫元素的化合价变化为:由+4价变为0价,所以得失电子最小公倍数是4,则该反应中转移电子方向和数目为: ,故答案为:
,故答案为: ;
;
②该反应中氧化产物和还原产物都是S,若氧化产物比还原产物多1.6g,则该反应中转移电子个数=
×4NA=1.204×1023,故答案为:1.204×1023.
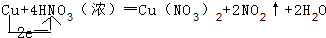 ,
,故答案为:
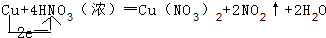 ;
;②该反应中得电子化合价降低的是硝酸,失电子化合价升高的是铜,所以硝酸是氧化剂,硝酸铜是氧化产物,故答案为:HNO3;Cu(NO3)2;
③该反应的离子反应方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O;
(2)①该反应中,硫化氢中硫元素的化合价变化由-2价变为0价,二氧化硫中硫元素的化合价变化为:由+4价变为0价,所以得失电子最小公倍数是4,则该反应中转移电子方向和数目为:
 ,故答案为:
,故答案为: ;
;②该反应中氧化产物和还原产物都是S,若氧化产物比还原产物多1.6g,则该反应中转移电子个数=
| 1.6g |
| 32g/mol |
点评:本题考查了氧化还原反应,明确元素化合价变化是解本题关键,难点是电子转移的方向和数目的分析.

练习册系列答案
相关题目