题目内容
结合下图判断,下列叙述正确的是
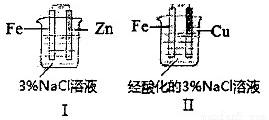
A.I和Ⅱ中正极均被保护
B.I和Ⅱ中负极反应均是Fe-2e-=Fe2+
C.I和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D.I和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀
A
【解析】
试题分析:A、题给装置I、II都是原电池,活泼金属作负极,首先被腐蚀,不活泼金属作正极,被保护;故A对;B、I中的负极反应式为:Zn-2e-=Zn2+,而II中负极是铁,反应式为:Fe-2e-=Fe2+,故B错;C、I溶液显中性,其电极反应式为:O2+2H2O+4e-=4OH-,而II溶液显酸性,电极反应式为:2H++2e-=H2↑,故C错;D、I中没有Fe2+,不能与K3[Fe(CN)6]生成蓝色的Fe3[Fe(CN)6]2沉淀,故D错;故选A.
考点:原电池的工作原理以及金属的腐蚀及防护

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“>”“<”或“=”);
(2)830℃时,向一个5L密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1,则6s时c(A)= mol·L-1,C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为
,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母);
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为