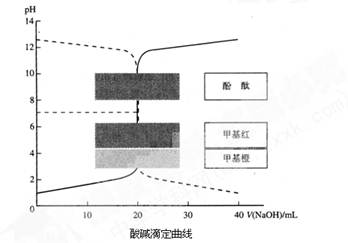
题目内容
用0.05 mol·L-1 Ba(OH)2溶液滴定20 mL盐酸和硫酸的混合酸,下图分别表示Ba(OH)2溶液的加入量与溶液pH及生成沉淀量的关系,求混合酸中Cl-、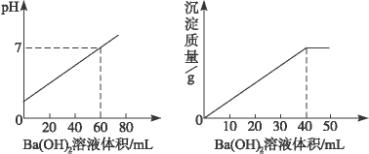
C(H+)=______________________;
C(![]() )=__________________;
)=__________________;
C(Cl-)=_____________________。
0.3 mol·L-1 0.1 mol·L-1 0.1 mol·L-1
解析:从图象上看出,中和20 mL盐酸与H2SO4的混合酸,需消耗60 mL Ba(OH)2溶液。
n〔Ba(OH)2〕=0.05 mol·L-1×0.06 L=0.003 mol,
n(OH-)=2n〔Ba(OH)2〕=2×0.003 mol=0.006 mol,
则混合酸中的c(H+)=![]() =0.3 mol·L-1。
=0.3 mol·L-1。
另从生成沉淀的图象上可看出:消耗Ba(OH)2 40 mL 时,生成沉淀的质量最大,这表示此时![]() 已反应完全。
已反应完全。
因Ba2++![]() ====BaSO4↓
====BaSO4↓
故n(![]() )=n(Ba2+)=n〔Ba(OH)2〕=0.04 L×0.05 mol·L-1=0.002 mol,
)=n(Ba2+)=n〔Ba(OH)2〕=0.04 L×0.05 mol·L-1=0.002 mol,
c(![]() )=
)=![]() =0.1 mol·L-1。
=0.1 mol·L-1。
又知混合酸中c(H+)=0.006 mol,
所以c(Cl-)=c(HCl)
=![]() =0.1 mol·L-1。
=0.1 mol·L-1。

练习册系列答案
相关题目