题目内容
【题目】在2L的密闭绝热容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列叙述不正确的是
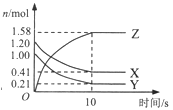
A. 反应开始到10s时,转化率:Y>X
B. 若前10s容器内的压强增加,说明生成Z的反应为放热反应
C. 由图像可知前10s内生成Z的速率越来越快
D. 若X为紫色,Y、Z无色,则10s后混合气体颜色不再变化
【答案】C
【解析】A.根据图象数据可知,反应开始到10s时,X的转化率为(1.20-0.41)÷1.20×100%=65.8%,Y的转化率为(1.00-0.21)÷1.00×100%=79%,转化率:Y>X,A项正确;B.由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,为生成物,当反应进行到10min时,△n(X)=0.79mol,△n(Y)=0.79mol,△n(Z)=1.58mol,则 △n(X):△n(Y):△n(Z)=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为X(g)+Y(g)2Z(g),该反应为气体系数和不变的可逆反应,若前10s容器内的压强增加,根据“热胀冷缩”原理,该反应为放热反应,B项正确;C.由图像可知,生成Z的曲线斜率一开始大,后来变小,说明生成Z的速率先快后慢,C项错误;D.根据图象可知在10s后,X、Y、Z的物质的量不再随时间的变化而变化,即反应达到平衡状态,各组分的浓度不再变化,即10s后混合气体颜色不再变化,D项正确。答案选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】具有中间价态的物质既可被氧化又可被还原,下表中的内容有错误的是
选项 | 具有中间价态的物质 | 还原产物 | 氧化产物 |
A | Fe2+ | Fe | Fe3+ |
B | SO32- | S | SO42- |
C | H2O2 | H2O | O2 |
D | N2 | NH3 | N2H4 |
A. A B. B C. C D. D

