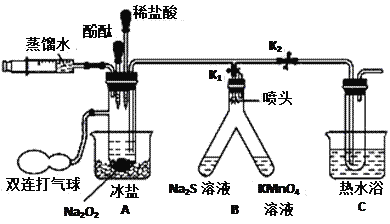
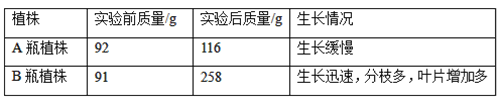
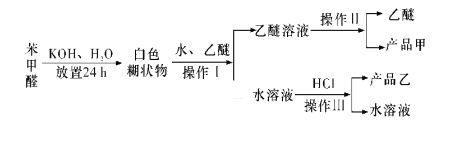
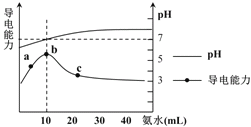
题目内容
【题目】在密闭容器中的一定量A、B混合气体发生反应:aA(g)+bB(g) ![]() cC(g)。平衡时测得A的浓度为0.5 mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28 mol/L。下列有关判断不正确的是( )
cC(g)。平衡时测得A的浓度为0.5 mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28 mol/L。下列有关判断不正确的是( )
A.a+b>cB.C的体积分数增大
C.该变化使平衡逆向移动D.B的转化率降低
【答案】B
【解析】
反应aA(g)+bB(g) ![]() cC(g)在平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,若化学平衡不移动,A的浓度应该为0.25 mol/L,而再达平衡时,测得A的浓度为0.28 mol/L,则说明体积增大(压强减小)化学平衡逆向移动。
cC(g)在平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,若化学平衡不移动,A的浓度应该为0.25 mol/L,而再达平衡时,测得A的浓度为0.28 mol/L,则说明体积增大(压强减小)化学平衡逆向移动。
A.减小压强,化学平衡逆向移动,逆反应方向为气体体积增大的方向,所以a+b>c,A正确;
B.减小压强,化学平衡逆向移动,则达到平衡时,生成物C的体积分数会减小,B错误;
C.容器容积是原来的一半,即减小体系的压强,反应物A的浓度比原来浓度的一半0.25 mol/L大,说明减小压强,化学平衡向逆向移动,C正确;
D.减小压强,化学平衡逆向移动,则达到平衡时,反应物B转化率降低,D正确;
故合理选项是B。

练习册系列答案
相关题目