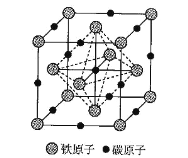
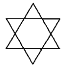
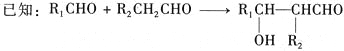题目内容
【题目】二甲醚(CH3OCH3)是一种清洁能源。工业上,常利用CO2和H2合成二甲醚。有关反应如下(z、y、z均大于0):
①2CH3OH(g)CH3OCH3(g)+H2O(g) △H1= -xkJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g) △H2= -ykJ·mol-1
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3= -zkJ·mol-1
(1)2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H= ___________kJ·mol-1
(2)下列有关合成二甲醚的说法正确的是 ___(填字母)。
a.增大压强能提高反应速率和CO2的平衡转化率
b.体系中减小![]() ,平衡一定向正方向移动
,平衡一定向正方向移动
c.容器体积一定,混合气体密度不变时一定达到平衡状态
d.充入适量CO,可能提高CH3OCH3的产率
(3)在一定温度下,在恒容密闭容器中发生反应:CO(g)+H2O(g)CO2(g)+H2(g),速率表达式为v=v正-v逆=k正c(CO)·c(H2O)-k逆c(CO2)·c(H2O)(其中,k正、k逆为正、逆速率常数,与浓度无关)。达到平衡时,升高温度,![]() 将_____选填“增大”“减小”或“不变”)。
将_____选填“增大”“减小”或“不变”)。
(4)在恒容密闭容器中用CO2和H2合成二甲醚时CO2的平衡转化率与温度、投料比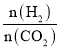 的关系如图所示。
的关系如图所示。
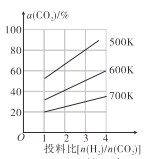
①500K时,将9mol H2和3mol CO2充入2L恒容密闭容器中,5min时反应达到平衡状态,则0~5min内的平均反应速率v(H2)=____________ molL-1min-l,该温度下,反应的平衡常数K=____(列出计算式即可,无需化简)。
②由图像可以得出的结论是_________(答两条)。
(5)工业上也可用CO和H2合成二甲醚,而且二者还能作燃料电池的燃料。以CO、H2体积比为1:2的混合气体与空气在KOH溶液中构成燃料电池(以石墨为电极),开始时,负极的电极反应式为____。
【答案】-(x+2z) ad 减小 0.72 ![]() 投料比不变,升高温度CO2的平衡转化率降低,温度不变,
投料比不变,升高温度CO2的平衡转化率降低,温度不变,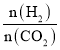 投料比越大,CO2的平衡转化率越大 CO+ 2H2 – 6e- +8OH- = CO32- + 6H2O
投料比越大,CO2的平衡转化率越大 CO+ 2H2 – 6e- +8OH- = CO32- + 6H2O
【解析】
(1)已知:①2CH3OH(g)CH3OCH3(g)+H2O(g) △H1= -xkJ·mol-1
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3= -zkJ·mol-1
根据盖斯定律可知①+2×③可得反应2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g),所以△H=△H1+2△H3=-(x+2z) kJ·mol-1;
(2)a.合成二甲醚的反应为气体体积减小的反应,所以增大压强可以提高反应速率同时使平衡正向移动,提高CO2的平衡转化率,故a正确;
b.若分离出CO2使体系![]() 减小,平衡逆向移动,故b错误;
减小,平衡逆向移动,故b错误;
c.容器体积不变,且反应物和生成物均为气体,则平衡移动过程中气体的质量不变,所以混合气体的密度一直不变,不能根据密度不变判断是否达到平衡,故c错误;
d.充入CO可使反应②平衡右移增大CO2的量,促使反应③正向移动,提高二甲醚的产率,故d正确;
故答案为ad;
(3)平衡状态时,正、逆反应速率相等,即k正c(CO)·c(H2O)=k逆c(CO2)·c(H2O),可得![]() =K(平衡常数),该反应正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,即
=K(平衡常数),该反应正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,即![]() 减小;
减小;
(4)①500K、投料比等于3时,CO2的平衡转化率为80%,容器体积为2L,则在该时间段内二氧化碳的平均反应速率为![]() =0.24 molL-1min-l,同一反应同一时段内不同物质反应速率之比等于计量数之比,所以v(H2)=3v(CO2)=0.72 molL-1min-l;列三段式有
=0.24 molL-1min-l,同一反应同一时段内不同物质反应速率之比等于计量数之比,所以v(H2)=3v(CO2)=0.72 molL-1min-l;列三段式有

则该反应的平衡常数K=![]() =
=![]() ;
;
②根据图像可知投料比不变,升高温度CO2的平衡转化率降低,温度不变,![]() 投料比越大,CO2的平衡转化率越大;
投料比越大,CO2的平衡转化率越大;
(5)CO和H2在反应过程中被氧化,所以在负极区充入,电解质溶液为KOH溶液,所以电极方程式为CO+ 2H2 – 6e- +8OH- =CO32- + 6H2O。

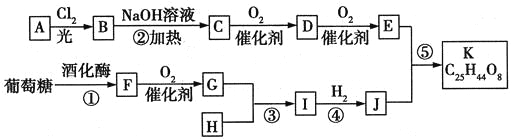
【题目】丙烯酸酯类物质广泛用于建筑、包装材料等,丙烯酸是合成丙烯酸酯的原料之一。丙烯醇可用于生产甘油、塑料等。以丙烯醛为原料生产丙烯醇、丙烯酸的流程如图所示:

已知:
①2CH2=CH-CHO+NaOH![]() CH2=CHCH2OH+CH2=CHCOONa
CH2=CHCH2OH+CH2=CHCOONa
②2CH2=CHOONa+H2SO4→2CH2=CHCOOH+Na2SO4
③有关物质的相关性质如表:
物质 | 丙烯醛 | 丙烯醇 | 丙烯酸 | 四氯化碳 |
沸点/℃ | 53 | 97 | 141 | 77 |
熔点/℃ | - 87 | - 129 | 13 | -22.8 |
密度/g·mL-3 | 0.84 | 0.85 | 1.02 | 1.58 |
溶解性(常温) | 易溶于水和有机溶剂 | 溶于水和有机溶剂 | 溶于水和有机溶剂 | 难溶于水 |
(1)操作①需要连续加热30min,所用装置如图所示。仪器L名称是________。

(2)操作②使用的主要仪器是分液漏斗,在使用之前需进行的操作是 ___。
(3)操作④包括____、过滤、冰水洗涤、低温吸干。
(4)操作⑤中,加热蒸馏“下层液体”,分离出四氯化碳;再分离出丙烯醇(如图),要得到丙烯醇应收集 ____(填温度)的馏分。图中有一处明显错误,应改为____。

(5)测定丙烯醇的摩尔质量:准确量取amL丙烯醇于分液漏斗中,烧瓶内盛装足量钠粒。实验前量气管B中读数为b mL,当丙烯醇完全反应后,冷却至室温、调平B、C液面,量气管B的读数为c mL。已知室温下气体摩尔体积为VL·mol-1。

调平B、C液面的操作是____;实验测得丙烯醇的摩尔质量为____g·mol-1(用代数式表示)。如果读数时C管液面高于B管,测得结果将____(填“偏大”“偏小”或“不变”)。