题目内容
下列解释实验事实的方程式正确的是
| A.Al2(SO4)3溶液滴加氨水产生白色胶状沉淀: Al3++3OH-= Al(OH)3↓ |
B.90 ℃时,测得纯水中c(H+)·c(OH-) =3.8×10—13: H2O(l) H+(aq)+OH-(aq)?H<0 H+(aq)+OH-(aq)?H<0 |
| C.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2 +2H2O = 2Fe2++SO42-+ 4H+ |
D.碳酸钠溶液滴入酚酞变红:CO32-+ 2H2O  H2CO3+2OH- H2CO3+2OH- |
C
解析试题分析:A项氨水为弱碱不能拆写,错误;B项提供的信息可知温度升高水的离子积增大,由此得出水的电离为吸热,即?H>0,错误;C项先根据得失电子守恒有2Fe3++SO2 ―― 2Fe2++SO42-,再根据电荷守恒有2Fe3++SO2 ――2Fe2++SO42-+ 4H+,最后根据原子守恒得2Fe3++SO2 +2H2O = 2Fe2++SO42-+ 4H+,正确;D项碳酸钠应分步水解:CO32-+ H2O  HCO3- + OH-,错误。
HCO3- + OH-,错误。
考点:本题考查离子方程式的正误判断。

练习册系列答案
相关题目
下列离子方程式书写正确的是
| A.向NH4HCO3溶液中加过量Ca(OH)2溶液:HCO3-+OH-+Ca2+=CaCO3↓+H2O |
B.用惰性电极MgCl2电解水溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
C.向偏铝酸钠溶液中加入少量硫酸氢钠溶液:2AlO2 +H +H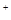 +H2O=Al(OH)3↓ +H2O=Al(OH)3↓ |
D.浓盐酸跟二氧化锰混合共热:MnO2+4H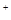 +4Cl +4Cl =Mn =Mn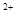 +2H2O+2Cl2↑ +2H2O+2Cl2↑ |
能大量共存于同一溶液中,且当改变条件使水电离的c(H+)=10-13mol/L时,一定能发生反应的离子组是
| A.S2-、Na+、SO32-、Cl- | B.Ca2+、NH 、SO 、SO 、SiO32- 、SiO32- |
C.Na+、Ba2+、Cl-、HSO | D.Al3+、Na+、SO 、NO 、NO |
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
| A.1.0mol?L -1的HNO3溶液:NH4+、[Ag(NH3)2]+、Cl-、SO42- |
| B.c(H+)/c(OH-)=10-11的溶液:Na+、Ba2+、NO3-、Cl- |
| C.滴入酚酞显红色的溶液:Ca2+、Al3+、NO3-、HCO3- |
| D.滴入碘化钾淀粉溶液显蓝色的溶液:Na+、Fe2+、ClO-、SO42- |
下列表示对应化学反应的离子方程式正确的是( )
A.明矾溶液中滴加过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH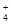 |
| B.醋酸溶液与Mg(OH)2反应:Mg(OH)2+2H+===Mg2++2H2O |
C.小苏打溶液中加足量澄清石灰水:2HCO +Ca2++2OH-===CaCO3↓+2H2O+CO +Ca2++2OH-===CaCO3↓+2H2O+CO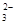 |
D.SO2通入FeCl3溶液中:SO2+Fe3++2H2O===SO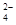 +Fe2++4H+ +Fe2++4H+ |
下列有关Fe2(SO4)3溶液的叙述正确的是
| A.该溶液中K+、Fe2+、C6H5OH、Br-可以大量共存 |
B.和KI溶液反应的离子方程式:Fe3++2I- Fe2++I2 Fe2++I2 |
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42—+Ba2++3OH- Fe(OH)3+ BaSO4 Fe(OH)3+ BaSO4 |
| D.1 L0.1 mol·L—1该溶液和足量的Zn充分反应,生成11.2 g Fe |
下列事实、离子方程式及其对应关系均正确的是.
| A.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2=2I2+2H2O |
B.向K2Cr2O7溶液中滴加少量浓硫酸,溶液变为黄色: Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+ 2CrO42-(黄色)+2H+ |
| C.0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH )2溶液等体积混合有白色沉淀生成: Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
D.用铜电极电解饱和食盐水:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
下列离子方程式表达正确的是
| A.碘化亚铁溶液中通入少量氯气:Cl2+2Fe2+=2Fe3++2Cl— |
| B.向1mol/L 0.1L的明矾溶液中加入0.5mol/L 0.2L的Ba(OH)2溶液: 2Al3++3SO42—+ 3Ba2++6OH—=2Al(OH)3↓+3BaSO4↓ |
| C.将蛋壳浸泡到醋酸中:CO32—+2CH3COOH=2CH3COO—+ CO2↑+H2O |
| D.将过氧化钠与水反应:2O22—+2H2O=O2+4OH— |
 mol
mol ,满足此条件的溶液中一定可以大量共存的离子组是:
,满足此条件的溶液中一定可以大量共存的离子组是: