题目内容
6.金属阳离子R3+核外有28个电子,其质量数为70,则核内的中子数是( )| A. | 42 | B. | 39 | C. | 31 | D. | 28 |
分析 根据阳离子中核内质子数=核外电子数+电荷数,中子数=质量数-质子数,据此分析解答.
解答 解:阳离子中核内质子数=核外电子数+电荷数=28+3=31,中子数=质量数-质子数=70-31=39,
故选:B.
点评 本题考查了离子中电子数、质子数、中子数和质量数之间的关系,难度不大,明确阳离子中核内质子数=核外电子数+电荷数,阴离子中核内质子数=核外电子数-电荷数.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
17.某有机物X(C4H6O5)广泛存在于许多水果内,该化合物具有如下性质:
①1molX与足量金属钠反应产生1.5mol气体;
②在有浓H2SO4和加热条件下,X与醇或羧酸均反应生成有香味的产物;
③X在一定条件下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应.
根据上述信息,对X的结构判断正确的是( )
①1molX与足量金属钠反应产生1.5mol气体;
②在有浓H2SO4和加热条件下,X与醇或羧酸均反应生成有香味的产物;
③X在一定条件下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应.
根据上述信息,对X的结构判断正确的是( )
| A. | X中含有碳碳双键 | B. | X中含有一个羧基和两个羟基 | ||
| C. | X中含有两个羧基和一个羟基 | D. | X中含有三个羟基和一个-COOR |
14.如图是产生和收集气体的实验装置,该装置适合于( )


| A. | 用浓硝酸与Cu反应制取NO2 | B. | 用浓盐酸和MnO2反应制取Cl2 | ||
| C. | 用H2O2溶液和MnO2反应制取O2 | D. | 用NH4Cl和Ca(OH)2反应制取NH3 |
1.前中国科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成化合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且其结构也没有发生改变,得到了可供衍射实验的单晶体.已知H2O2的结构式为H-O-O-H,下列说法中不正确的是( )
| A. | H2NCONH2与H2O2是通过氢键结合的 | B. | H2O2分子中只含σ键,不含π键 | ||
| C. | H2O2既有氧化性又有还原性 | D. | H2NCONH2•H2O2属于离子化合物 |
11.在2L密闭容器中加入4molA和6molB,发生以下反应:4A(g)+6B(g)?4C(g)+5D(g).若经5s后,剩下的A是2.5mol,则A的反应速率是( )
| A. | 0.45 mol/(L•s) | B. | 0.15 mol/(L•s) | C. | 0.225 mol/(L•s) | D. | 0.9 mol/(L•s) |
18.表是元素周期表的一部分,有关说法正确的是( )
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | c | d | |||||
| 3 | a | b | e | f |
| A. | e的氢化物比d的氢化物稳定 | |
| B. | a、b、e三种元素的原子半径:e>b>a | |
| C. | 六种元素中,c元素单质的化学性质最活泼 | |
| D. | c、e、f的最高价氧化物对应的水化物的酸性依次增强 |
15.下列实验操作可以达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 验证乙炔能被酸性高锰酸 钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性 高锰酸钾溶液,观察溶液是否褪色 |
| B | 验证苯和液溴在FeBr3的 催化下发生取代反应 | 将反应产生的混合气体通入AgNO3溶液上方, 观察是否有淡黄色沉淀生成 |
| C | 除去乙酸乙酯中混有的少 量乙酸 | 加入足量饱和Na2CO3溶液,振荡,静置,分液, 取出上层液体 |
| D | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝 酸银溶液,观察是否出现淡黄色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
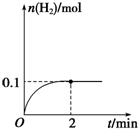 一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.
一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI?H2+I2,H2物质的量随时间的变化如图所示.
