题目内容
12.(亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,常用于水的消毒以及纺织高漂白.过氧化氢法生产亚氯酸钠的流程图如下
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O且NaClO2在碱性条件下稳定性较高.试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O
(2)在NaClO2稳定装置中,H2O2作B(选填序号).
A.氧化剂 B.还原剂 C.既作氧化剂又作还原剂D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是BEA(按实验后顺序填写操作代号).
A.过滤 B.加热 C.分液 D.蒸馏 E.冷却
(4)经查阅资料知道:当pH≤2.0时,ClO-2能被I完全还原成Cl-;
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6.
欲测定成品中NaClO2的含量,现进行如下操作:
| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节PH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol.L- 的Na2S2O3溶液滴定 |
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数$\frac{9.05×1{0}^{-2}Vc}{4W}$×100%(用字母表示).
分析 (1)NaClO3和HCl反应,生成ClO2,可以写出方程式,并用化合价升降法配平得到;
(2)在NaClO2稳定装置中,加入过氧化氢是还原高价的氯的化合物得到NaClO2;
(3)溶液中得到溶质固体的方法是蒸发浓缩、冷却结晶、过滤洗涤得到;
(4)①步骤Ⅱ中发生反应是酸性溶液中ClO2-能被I-完全还原成Cl-,碘离子被氧化为碘单质,溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6.溶液颜色蓝色变化为无色分析判断反应终点;
②依据ClO2-+4H++4I-=2I2+Cl-+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,反应的定量关系计算得到样品中NaClO2的质量分数.
解答 解:(1)2NaClO3+和盐酸发生歧化反应,生成NaCl、2ClO2、Cl2、H2O,化学方程式为:2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O,
故答案为:2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O;
(2)适当条件下可结晶析出NaClO3•3H2O,在NaClO2稳定装置中,H2O2作还原剂,还原NaClO3为NaClO2,
故答案为:B;
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是溶液中得到溶质固体的方法是蒸发浓缩、冷却结晶、过滤洗涤,
故答案为:BEA;
(4)①步骤Ⅱ中发生反应是酸性溶液中ClO2-能被I-完全还原成Cl-,碘离子被氧化为碘单质,离子方程式为:ClO2-+4H++4I-=2I2+Cl-+2H2O,溶液中Na2S2O3能与I2反应:2Na2S2O3+I2=2NaI+Na2S4O6.溶液颜色蓝色变化为无色分析判断反应终点,滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化,
故答案为:ClO2-+4H++4I-=2I2+Cl-+2H2O,滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化.
②依据ClO2-+4H++4I-=2I2+Cl-+2H2O,2Na2S2O3+I2=2NaI+Na2S4O6,反应的定量关系计算得到,设NaClO2,
ClO2-~2I2~4Na2S2O3
1 4
x cV×10-3mol
x=$\frac{cV×1{0}^{-3}}{4}$mol,
样品中NaClO2的质量分数=$\frac{\frac{cV×1{0}^{-3}}{4}×90.5g/mol}{Wg}$×100%=$\frac{9.05×1{0}^{-2}Vc}{4W}$×100%,
故答案为:$\frac{9.05×1{0}^{-2}Vc}{4W}$×100%.
点评 本题考查亚氯酸钠制备实验的基本操作、亚氯酸钠的性质及中和滴定等知识,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,难度中等.



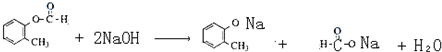
 C6H5COOCH3+H2O.
C6H5COOCH3+H2O.
 .
.
 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应.
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应. 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.