题目内容
【题目】将镁铝合金溶于100mL稀硝酸中,产生1.12LNO气体(标准状况),向反应后的溶液中加入NaOH溶液,产生沉淀情况如图所示。下列说法不正确的是

A. 原溶液中c(HNO3)=2.6mol/L B. 沉淀最大质量为4.08g
C. m(Mg):m(Al)=8:9 D. 氢氧化钠溶液浓度为3mol/L
【答案】A
【解析】
向反应溶液中加入NaOH溶液,开始没有沉淀,说明硝酸过量,与硝酸反应的NaOH溶液是10mL,从开始沉淀到沉淀达到最大时消耗NaOH溶液是50mL,溶解氢氧化铝消耗NaOH溶液是10mL,则生成氢氧化铝消耗NaOH溶液是30mL,所以生成氢氧化镁消耗的NaOH溶液20mL。1.12LNO气体(标准状况)的物质的量为1.22L÷22.4L/mol=0.05mol,则转移的电子总数为n(e-)=0.15mol,设镁铝合金中镁的物质的量为xmol,铝的物质的量为ymol,根据得失电子守恒得2x+3y=0.15,根据生成氢氧化铝消耗NaOH溶液是30mL,生成氢氧化镁消耗的NaOH溶液20mL,根据方程式对应关系Al3++3OH-=Al(OH)3![]() ,Mg2++2OH-=Mg(OH)2
,Mg2++2OH-=Mg(OH)2![]() 可得x=y,两式结合解得x=y=0.03mol;根据溶解氢氧化铝消耗NaOH溶液是10mL,由Al(OH)3+OH-=2H2O+AlO2-可知氢氧化钠的物质的量浓度为0.03mol÷0.01L=3mol/L。
可得x=y,两式结合解得x=y=0.03mol;根据溶解氢氧化铝消耗NaOH溶液是10mL,由Al(OH)3+OH-=2H2O+AlO2-可知氢氧化钠的物质的量浓度为0.03mol÷0.01L=3mol/L。
A、可根据沉淀达到最大时所得溶液是硝酸钠,根据钠离子守恒与硝酸根守恒可知硝酸的物质的量为n(HNO3)=n(NO)+2n(Mg2+)+3n(Al3+)+3mol/L×10mL=0.05mol+0.06mol+0.09mol+0.03mol=0.23mol,所以 原溶液中c(HNO3)=n/V=2.3mol÷0.1L=2.3mol/L,故A符合题意;
B、根据上述分析可知,沉淀最大时为氢氧化镁和氢氧化铝,质量为n(Mg(OH)2)×M(Mg(OH)2)+n(Al(OH)3)×M(Al(OH)3)=4.08g,故B不符合题意;
C、根据上述分析可知,镁和铝的物质的量均为0.03mol,则质量之比为摩尔质量之比24:27=8:9,故C不符合题意;
D、根据上述分析可知,氢氧化钠溶液浓度为3mol/L,故D不符合题意;
综上所述,本题应选A。

【题目】向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是
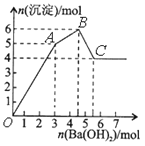
氢氧化物 | 溶液pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)3 | 2.3 | 3.4 |
Al(OH)3 | 3.3 | 5.2 |
A. OA段产生的沉淀为BaSO4和Fe(OH)3
B. 据图计算原溶液中c(Cl-)=c(SO42-)
C. AB段可能发生的反应是:2SO42-+ 2Ba2++ Al3++3OH-=2BaSO4↓+Al(OH)3↓
D. C点溶液呈碱性是因为AlO2-水解,离子方程式为:AlO2-+2H2O=Al(OH)3+OH-